Hydrogencyanid
| Hydrogencyanid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikasjon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC-navn | hydrogencyanid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonymer |
Hydrocyanic |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.000.747 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 200-821-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMIL |
C ([H]) # N , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / CHN / c1-2 / h1H |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Utseende | fargeløs væske eller gass med en karakteristisk lukt | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kjemiske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formel | HCN | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molarmasse | 27,0253 ± 0,0011 g / mol C 44,44%, H 3,73%, N 51,83%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | 9.2 - 9.3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dipolar øyeblikk | 2.985188 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysiske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fusjon | −13 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° kokende | 26 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Løselighet | i vann: blandbar, blandbar med etanol |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Løselighetsparameter δ | 24,8 MPa 1/2 ( 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumisk masse |
0,69 g cm −3 (væske)
ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Selvantennelsestemperatur | 538 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Flammepunkt | −18 ° C (lukket kopp) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eksplosjonsgrenser i luft | 5,6 - 40,0 % vol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mettende damptrykk | ved 20 ° C : 82,6 kPa
ligning:
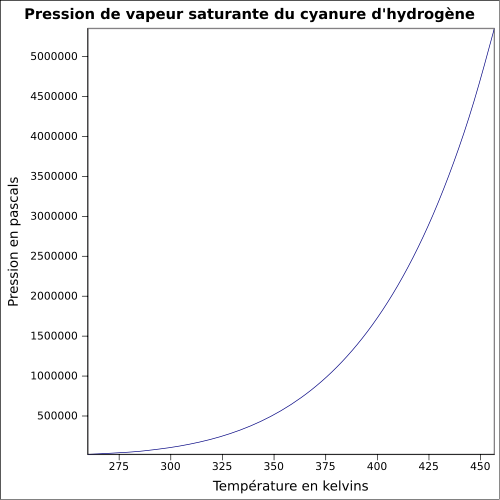
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dynamisk viskositet | 0,192 mPa · s ( 20 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritisk punkt | 53,9 bar , 183,55 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termokjemi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 væske, 1 bar | 109 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 væske | 113,01 J / mol K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C s | 71,09 J mol -1 K -1 ( 20 ° C , væske) 35,85 J · mol -1 · K -1 ( 25 ° C , gass) ligning:
ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCS | 671,5 kJ · mol -1 ( 25 ° C , gass) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroniske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re ioniseringsenergi | 13,60 ± 0,01 eV (gass) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forholdsregler | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Fare H224, H330, H410, H224 : Ekstremt brannfarlig væske og damp H330 : Dødelig ved innånding H410 : Meget giftig for vannlevende organismer, med langvarige effekter   Fare H300, H310, H330, H410, H300 : Dødelig ved svelging H310 : Dødelig ved hudkontakt H330 : Dødelig ved innånding H410 : Meget giftig for vannlevende organismer, med langvarige virkninger |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   B2, D1A, F, B2 : Brannfarlig væskeflammepunkt = −18 ° C lukket kopp (metode ikke rapportert) D1A : Meget giftig materiale med alvorlige øyeblikkelige effekter Transport av farlig gods: klasse 6.1 gruppe I F : Farlig reaktivt materiale utsatt for en voldsom reaksjon av polymerisering 1.0% offentliggjøring i henhold til listen over ingredienser |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 4 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transportere | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1051 : VÆSKECYANID, STABILISERT, med mindre enn 3 prosent vann Klasse: 6.1 Klassifiseringskode: TF1 : Brannfarlige giftige stoffer: Væsker; Etiketter: 6.1 : giftige materialer 3 : Brennbare væsker emballering: Emballasje gruppe I : meget farlige stoffer;  
663 : meget giftig og brannfarlig stoff (flammepunkt lik eller mindre enn 60 ° C ) FN-nummer : 1613 : HYDROCYANIC ACID IN AQUEOUS SOLUTION inneholder ikke mer enn 20 prosent hydrogencyanid; eller HYDROGEN CYANIDE QUEOUS SOLUTION som inneholder ikke mer enn 20 prosent hydrogencyanid Klasse: 6.1 Klassifiseringskode: TF1 : Brannfarlige giftige materialer: Væsker; Etiketter: 6.1 : giftige materialer 3 : Brennbare væsker emballering: Emballasje gruppe I : meget farlige stoffer;  
1614 : VÆSKECYANID, STABILISERT, med mindre enn 3 prosent vann og absorbert i inert porøst materiale Klasse: 6.1 Klassifiseringskode: TF1 : Brannfarlige giftige materialer: Væsker; Etiketter: 6.1 : giftige materialer 3 : Brennbare væsker emballering: Emballasje gruppe I : meget farlige stoffer;  
663 : meget giftig og brannfarlig stoff (flammepunkt lik eller under 60 ° C ) FN-nummer : 3294 : VÆSKECYANID, ALKOHOLISK LØSNING som inneholder ikke mer enn 45 prosent hydrogencyanid Klasse: 6.1 Kode Klassifisering: TF1 : Brennbar giftige materialer: Væsker; Etiketter: 6.1 : giftige materialer 3 : Brennbare væsker emballering: Emballasje gruppe I : meget farlige stoffer;   |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Innånding | Veldig giftig | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hud | Veldig giftig | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Øyne | Årsaker konjunktivitt | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Svelging | Veldig giftig | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Økotoksikologi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | −0.25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Luktterskel | lav: 2 spm høy: 10 spm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Enheter av SI og STP med mindre annet er oppgitt. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Den hydrogencyanid er en kjemisk forbindelse med kjemisk formel HC≡N. En vandig løsning av cyanid av hydrogen kalles hydrocyansyre (eller preussinsyre ).
Det er et ekstremt giftig produkt og kan være dødelig fordi det forårsaker anoksi . I naturen er det ofte assosiert med benzaldehyd som avgir en karakteristisk bitter mandellukt , som noen ikke er følsomme for.
Historie
Hydrogencyanid ble opprinnelig isolert fra et blått pigment ( preussisk blått ), kjent siden 1704, men hvis struktur var ukjent. Vi vet nå at det er en koordineringspolymer, med en kompleks struktur og en empirisk formel av hydratisert jernferrocyanid.
I 1752 viste den franske kjemikeren Pierre Macquer at preussisk blått kunne omdannes til jernoksid og en flyktig forbindelse, og at kombinasjonen av disse to produktene ga tilbake preussisk blått. Den nye forbindelsen var nettopp hydrogencyanid. Etter Macquer syntetiserte den svenske kjemikeren Carl Wilhelm Scheele hydrogencyanid i 1782, og han kalte det Blausäure ( bokstavelig talt "Acid of blue"), etter å ha anerkjent syrligheten. På engelsk var det bedre kjent som preussinsyre.
I 1787 viste den franske kjemikeren Claude Louis Berthollet at hydrogencyanid ikke inneholdt oksygen, noe som var viktig for teorien om syrer , idet Lavoisier postulerte at alle syrer inneholdt oksygen (navnet på oksygen kommer fra gresk som betyr "som genererer surhet ", som for den tyske Sauerstoff ). I 1811 lyktes Joseph Louis Gay-Lussac å flytende ren hydrogencyanid, og deretter, i 1815, etablerte han sin kjemiske formel.
Naturkilder
Ekstremt giftig, hydrocyansyre produseres naturlig av visse planter, og kan spesielt finnes i bitre mandler, ferskenstein (og mer generelt steiner av frukt av slekten Prunus ), medlars , kirsebærblader ( Prunus avium ) og kirsebærlaurbær ( Prunus laurocerasus ), sorghum (unge planter og umodne frø), hyllebær og kassava . Det er også involvert i aromaen av kirsebær (som benzaldehyd).
Den er tilstede i cyanohydriner som mandelonitriler , og kan ekstraheres derfra kjemisk. Noen tusenben avgir hydrogencyanid som en forsvarsmekanisme. Den er inneholdt i eksosgassene fra forbrenningskjøretøyer, i tobakkrøyk og i forbrenningsrøyk fra visse nitrogenholdige plaster - typisk polyakrylnitril og relaterte kopolymerer, ABS og SAN , men også polyuretan .
Forberedelse og syntese
Hydrogencyanid produseres i store mengder ved to prosesser:
- i Degussa prosess , den ammoniakk og metan reagere til 1200 ° C over en katalysator av platina .
- i Andrussow-prosessen tilsettes dioxygen:
- The Shawinigan Prosessen er ganske lik de foregående, men anvender hydrokarbonfraksjoner med propan som hovedkomponent:
- I laboratoriet produseres små mengder HCN ved innvirkning av syre på et alkali-cyanid.
Denne reaksjonen er kilden til utilsiktet forgiftning.
Eiendommer
Fysiske egenskaper
Hydrogencyanid forekommer i ren tilstand som en veldig flyktig fargeløs væske eller en fargeløs gass som puster ut en karakteristisk bitter mandellukt. Det koker ved 26 ° C .
Det er blandbart i alle proporsjoner med vann og etanol , løselig i dietyleter ( eter ).
Hydrogencyanidgass i luft er eksplosiv fra en konsentrasjon på 56 000 ppm (5,6%).
Kjemiske egenskaper
Rent hydrogencyanid er stabilt.
Mindre rent når det markedsføres, og hvis det ikke er stabilisert, polymeriserer det for å gi et brunt avleiringsmiddel. Denne prosessen, eksoterm og autokatalytisk, akselererer i nærvær av vann og alkaliske reagerende produkter, og kan dermed føre til en eksplosiv reaksjon. Den vanligste stabilisatoren er fosforsyre, brukt i proporsjoner fra 50 til 100 ppm .
Hydrogencyanid er svakt surt og produserer CN cyanidioner - i vandig løsning. Saltene av hydrocyansyre kalles cyanider.
Reaksjoner
HCN + R-CO-R '( keton eller aldehyd ) → RC (OH) (CN) -R' ( cyanohydrin )Hydrogencyanid brenner seg i luften og gir vann , karbondioksid og nitrogen .
Prebiotisk kjemi
Hydrocyansyre sies å ha dannet seg gjennom dissosiasjonen av molekylært nitrogen som er tilstede i atmosfæren. Ultrafiolette stråler kan utføre denne reaksjonen, forutsatt at de er tilstrekkelig energiske (bølgelengde mindre enn 100 nm ), som ekskluderer enhver reaksjon i de laveste lagene i atmosfæren der de mest energiske ultrafiolette strålene absorberes. Den foretrukne måten å syntetisere hydrosyansyre fra nitrogen ser ut til å være lyn, som frigjør betydelig energi på deres vei, i stand til å bryte mange molekyler. Når dinitrogen-molekylet er brutt, kan et nitrogenatom, reagere med en metan (CH 4 ) -molekyl under dannelse av blåsyre og hydrogen.
Diaminomaleonitril (en) tetramer dannes ved polymerisering av hydrogencyanid. Ved en fotokjemisk reaksjon blir den transformert til sin isomer 4-amino-imidazol-5-karbonitril, som deretter tillater syntese av mange heterosykler . Derfor anses det å være en mulig kandidatforbindelse i opprinnelsen til prebiotisk kjemi.
Bruker
Hydrogencyanid brukes til fremstilling av:
- av fumigatorer , av plantevernmidler ;
- av nitriler og harpiksmonomerer (spesielt akrylnitril brukes til produksjon av akrylfibre, plast);
- det er hovedelementet i Zyklon B , brukt i gasskamrene i nazistiske utryddelsesleirer .
sikkerhet
Se merkingen i henhold til EU-direktiver på slutten av denne artikkelen.
Brannfare
Hydrogencyanid, som har et flammepunkt på -17,8 ° C (lukket kopp), er ekstremt brannfarlig. Det kan danne eksplosive blandinger med luft, og eksplosjonsgrensene er 5,6 og 41 volum%.
Virksomheter åpne for publikum (ERP)
I Frankrike krever rekkefølgen 4. november 1975 som endret at massen av brennbare materialer som brukes i innredning ikke resulterer i en mengde nitrogen som kan frigjøres i form av hydrocyansyre større enn fem gram per kubikkmeter volum av de lokale ansett.
Toksisitet for mennesker
Akutt forgiftning kan oppstå ved svelging , innånding eller hudkontakt. En konsentrasjon på 300 ppm i luften dreper en mann i løpet av få minutter. Dens toksisitet skyldes cyanidionet. Hydrogencyanid brukes i USA som en metode for å gjennomføre dødsstraff og ble brukt av naziregimet (under navnet Zyklon B ) i utryddelsesleirene som et verktøy for "utryddelse av døden". Masse". Det samme produktet produseres fremdeles i dag i Tsjekkia, under navnet " Uragan D2 ", og brukes som et plantevernmiddel.
Den olfaktoriske oppfatningsgrensen er mindre enn 1 ppm i oppmerksomme, sunne og uvanlige forsøkspersoner; Imidlertid har mange mennesker av genetiske årsaker liten eller ingen sans for lukten av hydrogencyanid.
Konsentrasjoner i luften over 50 ppm inhalert i mer enn en halv time representerer en betydelig risiko, mens nivåer på 200 til 400 ppm eller mer anses å være dødelige etter eksponering i noen minutter. Som en guide er den dødelige dosen for rotter 484 ppm for en fem minutters eksponering.
Kilde
- Institut national de recherche et de sécurité, Hydrogen cyanide and aqueous solutions [PDF] , MSDS n o 4, 1997 Paris, 5 s.
I litteraturen
- I Embargo (1976) forestiller forfatteren Gérard de Villiers seg at terrorister dreper ofrene sine ved hjelp av hydrocyansyre.
- Vises i James Bond 007 Skyfall som motivet for Tiago Rodriguez (filmens fiende) å hevne seg på Mr.
- I Thérèse Raquin er det med hydrocyansyre at Thérèse og Laurent begår selvmord.
- Vises i Oscar Wildes portrett av Dorian Gray , det mistenkes at det var giften som førte Sybil Vane til døden.
På kinoen
- Den vandige løsningen av hydrogencyanid dukker opp under navnet preussinsyre under en dialog mellom Bernard Blier og Annie Girardot i filmen Elle cause plus ... elle flingue (1972) av Michel Audiard , og fremkaller en tidligere middag ansikt til ansikt mellom disse to tegn og som hadde endt dårlig.
- Brukt under navnet preussinsyre i filmen In Secret (2013) av kjærestene Laurent og Thérèse Raquin for å avslutte livet.
- Brukt i Jurassic World: Fallen Kingdom- filmen i Lokwood Mansion.
- Brukt i filmen "Skyfall" utgitt i 2012 under en dialog mellom M og eksagenten Da Silva fra MI6.
Merknader og referanser
- HYDROGEN CYANIDE, LIQUEFIED, sikkerhetsdatablad (er) til det internasjonale programmet for kjemisk sikkerhet , konsultert 9. mai 2009
- (i) David R. Lide, håndbok for kjemi og fysikk , Boca Raton, CRC,16. juni 2008, 89 th ed. , 2736 s. ( ISBN 978-1-4200-6679-1 og 1-4200-6679-X ) , s. 9-50
- beregnede molekylmasse fra " atomvekter av elementene 2007 " på www.chem.qmul.ac.uk .
- (in) James E. Mark, Physical Properties of Polymer Handbook , Springer,2007, 2 nd ed. , 1076 s. ( ISBN 978-0-387-69002-5 og 0-387-69002-6 , leses online ) , s. 294
- (en) Robert H. Perry og Donald W. Green , Perrys Chemical Engineers 'Handbook , USA, McGraw-Hill,1997, 7 th ed. , 2400 s. ( ISBN 0-07-049841-5 ) , s. 2-50
- " Properties of Various Gases ", på flexwareinc.com (åpnet 12. april 2010 )
- (i) Carl L. yaws, Handbook of Thermodynamic diagrammer , vol. 1, 2 og 3, Huston, Texas, Gulf Pub. Co.,1996( ISBN 0-88415-857-8 , 0-88415-858-6 og 0-88415-859-4 )
- (in) David R. Lide , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press,18. juni 2002, 83 th ed. , 2664 s. ( ISBN 0849304830 , online presentasjon ) , s. 5-89
- (i) David R. Lide, håndbok for kjemi og fysikk , Boca Raton, CRC,2008, 89 th ed. , 2736 s. ( ISBN 978-1-4200-6679-1 ) , s. 10-205
- Indeksnummer i tabell 3.1 i vedlegg VI til EF-forskrift nr. 1272/2008 (16. desember 2008)
- Indeksnummer i tabell 3.1 i vedlegg VI til EF-forskrift nr. 1272/2008 (16. desember 2008)
- " Hydrogencyanide " i databasen over kjemiske produkter Reptox fra CSST (Quebec-organisasjonen med ansvar for arbeidsmiljø og helse), åpnet 25. april 2009
- " Hydrogen cyanide " på hazmap.nlm.nih.gov (åpnet 14. november 2009 )
- Tom Maimone, PrebioticChemistry .
- Cleaves, HJ, Prebiotic Chemistry: What We Know, What We Don't , Evo. Edu. Outreach , 2012, 5, 342.
Se også
Relaterte artikler
Eksterne linker
- Toksikologisk ark [PDF] , INRS
- Internasjonalt sikkerhetsdatablad
- Ark [PDF] , INERIS








