Svoveldioksid
| Svoveldioksid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Struktur av svoveldioksid. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikasjon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC-navn | svoveldioksid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonymer |
svovel |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.028.359 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 231-195-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o RTECS | WS4550000 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 1119 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 18422 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o E | E220 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 3039 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMIL |
O = S = O , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / O2S / c1-3-2 InChIKey: RAHZWNYVWXNFOC-UHFFFAOYAT Std. InChI: InChI = 1S / O2S / c1-3-2 Std. InChIKey: RAHZWNYVWXNFOC-UHFFFAOYSA-N |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Utseende | fargeløs gass eller komprimert flytende gass, med en skarp lukt | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kjemiske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formel | S O 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molarmasse | 64,064 ± 0,006 g / mol O 49,95%, S 50,05%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dipolar øyeblikk | 1.63305 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molekylær diameter | 0,382 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysiske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fusjon | −75,5 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° kokende | −10 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Løselighet | i vann ved 25 ° C : 85 ml · l -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Løselighetsparameter δ | 12,3 J 1/2 · cm -3/2 ( 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
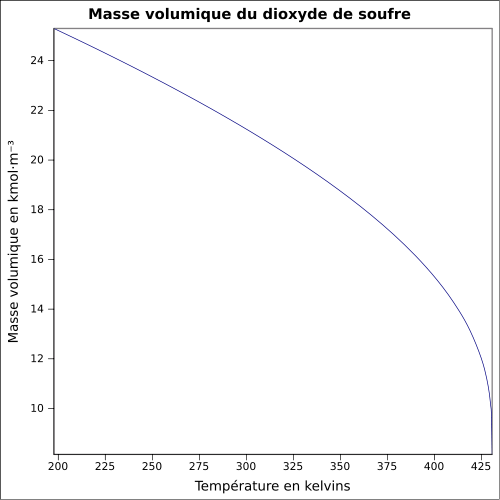
| Volumisk masse |
1,354 g · cm -3 til -30 ° C 1,434 g · cm -3 til 0 ° C 1,25 g · ml -1 ved 25 ° C 2,26 ved 21 ° C med hensyn til luft ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Selvantennelsestemperatur | ikke brennbar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Flammepunkt | ikke brennbar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eksplosjonsgrenser i luft | ikke-eksplosiv | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mettende damptrykk |
−10 ° C : 1.013 bar 20 ° C : 3.3 bar 40 ° C : 4.4 bar ligning:

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritisk punkt | 78,9 bar , 157,45 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lydens hastighet | 213 m · s -1 ( 0 ° C , 1 atm ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termokjemi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 gass, 1 bar | 248,21 J / mol K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 gass | -296,84 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vap H ° |
24,94 kJ · mol -1 ( 1 atm , -10,05 ° C ); 22,92 kJ · mol -1 ( 1 atm , 25 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
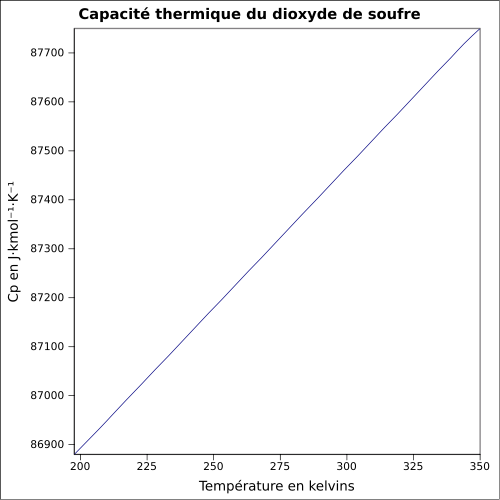
| C s |
ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroniske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re ioniseringsenergi | 12,349 ± 0,001 eV (gass) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Optiske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brytningsindeks | 1.357 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forholdsregler | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Fare H314, H331, H314 : Gir alvorlige etseskader på huden og øyeskader H331 : Giftig ved innånding |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   A, D1A, E, A : Komprimert gass absolutt damptrykk ved 50 ° C = 900 kPa D1A : Meget giftig materiale med alvorlige øyeblikkelige effekter Transport av farlig gods: klasse 2.3 E : Etsende materiale Transport av farlig gods: klasse 8 Avsløring ved 1,0% i henhold til ingrediensbeskrivelsen liste |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 0 3 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transportere | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
268 : giftig og etsende gass FN-nummer : 1079 : SVOVELDIOKSID Klasse: 2.3 Etiketter: 2.3 : Giftige gasser (tilsvarer grupper betegnet med store T, dvs. T, TF, TC, TO, TFC og TOC). 8 : Etsende stoffer   |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IARC- klassifisering | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe 3: ikke klassifiserbar med hensyn til kreftfremkallende virkning på mennesker | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Innånding | Svært giftig, død, produserer svovelsyre i lungene. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hud | Farlig, etsende, syredannelse ved kontakt med våte overflater. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Øyne | Farlig, etsende, syredannelse ved kontakt med våte overflater. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Svelging | Relativt lav toksisitet, ukjente langtidseffekter. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Økotoksikologi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CL 50 | 3000 ppm i 30 minutter (mus, innånding) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Luktterskel | lav: 0,33 spm høy: 5 spm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Enheter av SI og STP med mindre annet er oppgitt. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Den svoveldioksyd , tidligere også kjent som svoveldioksid , er en kjemisk forbindelse med formel SO 2. Det er en fargeløs, tett og giftig gass, hvis innånding er veldig irriterende. Det frigjøres i jordens atmosfære av vulkaner og ved mange industrielle prosesser , samt ved forbrenning av visse kull , oljer og ikke- avsvovlede naturgasser . Den oksydasjon av svoveldioksyd, vanligvis i nærvær av katalysatorer slik som nitrogendioksid NO 2, fører til svoveltrioksid SO 3og svovelsyre H 2 SO 4, derav dannelsen av surt regn . Det resulterer i betennelse i luftveiene.
Svoveldioksid brukes som desinfeksjonsmiddel , antiseptisk , antibakteriell , kjølemediumgass , blekemiddel, katalysatorgass for støperikjerner i Ashland-prosessen og som konserveringsmiddel for matvarer , spesielt for tørket frukt , i produksjonen av alkoholholdige drikker og ved fremstilling av vin .
Molekylstruktur
SO 2er en bøyd molekyl i hvilken den atom av svovel er i den oksydasjonstilstand +4. Fra et molekylær orbital teori er de fleste valenselektroner engasjert i en S = O- binding .
Lengden på S = O bindinger av SO 2er 143,1 um , lavere enn den for denne bindingen i svovelmonoksid SO ( 148,1 um ).
Analogt sett bindes O - O i ozon O 3( 127,8 pm ) er lengre enn i oksygen O 2( 120,7 pm ).
På samme måte er den gjennomsnittlige bindingsenergien høyere i SO 2( 548 kJ mol −1 ) enn i SO ( 524 kJ mol −1 ), mens den er lavere i O 3( 297 kJ mol −1 ) enn i O 2( 490 kJ mol −1 ).
Disse betraktningene har ført til at kjemikere konkluderer med at S = O-bindingene av svoveldioksid har en bindingsrekkefølge som er minst lik 2, i motsetning til OO-bindingene til ozon, som er i orden 1,5.
Produksjon
Svoveldioksid kan fremstilles:
- ved forbrenning av elementært svovel:
- ved forbrenning av hydrogensulfid eller organiske svovelforbindelser :
- som et restprodukt fra sementproduksjon : CaSiO 3og CaSO 4varmes opp med koks og sand ( silisiumdioksid ):
- av varm svovelsyre på kobberspon
Svoveldioksid oppløst i vann er en bifunksjonell syre , og er delt inn i tre fraksjoner i henhold til følgende balanser:
H 2 O + SO 2 H + + HSO 3 - 2 H + + SO 3 2– .Disse fraksjonene avhenger av termodynamiske konstanter og vinens pH .
En frigjøring av SO 2 er også erholdesved å blande natriummetabisulfitt Na 2 S 2 O 5med vinsyre i vann, et eksperiment som tilbys av visse innledende kjemiske eksperimenter.
Fysiske egenskaper
Mettende damptrykk:
| Temperatur | -103,15 ° C | −98,15 ° C | −93,15 ° C | −88,15 ° C | −83,15 ° C | −78,15 ° C | −73,15 ° C | −68,15 ° C | −63,15 ° C |
|---|---|---|---|---|---|---|---|---|---|
| Press | 0,1 kPa | 0,2 kPa | 0,3 kPa | 0,5 kPa | 0,8 kPa | 1,3 kPa | 2,0 kPa | 3,0 kPa | 4,4 kPa |
| Temperatur | -58,15 ° C | −53,15 ° C | −48,15 ° C | −43,15 ° C | −38,15 ° C | −33,15 ° C | −28,15 ° C | −23,15 ° C | −18,15 ° C |
|---|---|---|---|---|---|---|---|---|---|
| Press | 6,3 kPa | 9,0 kPa | 12,6 kPa | 17,3 kPa | 23,3 kPa | 31,1 kPa | 40,9 kPa | 53,2 kPa | 68,3 kPa |
| Temperatur | −13,15 ° C | −8,15 ° C | -3,15 ° C | 1,85 ° C | 6,85 ° C | 11,85 ° C | 16,85 ° C | 21,85 ° C | 26,85 ° C |
|---|---|---|---|---|---|---|---|---|---|
| Press | 86,7 kPa | 109 kPa | 136 kPa | 168 kPa | 205 kPa | 249 kPa | 300 kPa | 359 kPa | 426 kPa |
I industrien
I industrien brukes svoveldioksid primært til produksjon av svovelsyre . Sistnevnte har utallige anvendelser og er det mest brukte kjemikaliet alene eller i kombinasjon med andre stoffer, slik som tionylklorid SOCl 2. Svoveldioksid oppnås ved forbrenning av svovel eller svovelkis , deretter omformet til svoveltrioksyd (SO 3) veldig rent ved oksidasjon med luft, katalysert av platina eller vanadiumpentoksid . SÅ 3 således oppnådd tillater direkte fremstilling av høykonsentrert svovelsyre ved enkel hydrering.
Svoveldioksid luftforurensning fra industrien kommer hovedsakelig fra forbruk av fossilt brensel. Faktisk er svovel naturlig inneholdt i disse drivstoffene, og forbrenningen deres genererer SO 2.. Det kan også komme fra metallindustrien , produksjonsprosesser av svovelsyre, konvertering av tremasse til papir, forbrenning av søppel og produksjon av elementært svovel.
Forbrenning av kull er den viktigste syntetiske kilden og står for rundt 50% av de globale årlige utslippene. Oljen representerer fortsatt 25 til 30%.
Industrielle utslipp av svoveldioksid kan reduseres ved å implementere avsvovlingsprosesser .
I miljøet
SO 2naturlig er produsert av vulkaner .
Svoveldioksid spiller en avkjølende rolle for planeten, siden den fungerer som en kjernekjerne for aerosoler hvis albedo er ganske høy, det vil si å reflektere solstrålene uten å absorbere dem, men denne effekten varer ikke bare noen få år, hvor den for CO 2 nådde århundret.
Den siste store utbruddet av Pinatubo frigjorde opptil 5.000 t SO 2i luften (17 Mt totalt, den største mengden noensinne målt med moderne instrumenter), som påvirket ozonlaget og endret været ved å avkjøle planeten betydelig og endre nedbør i minst to år. Det skal imidlertid bemerkes at i 1986 var menneskeskapte utslipp fra USA alene (17,1 Mt ) sammenlignbare med denne rekordstore Pinatubo-utslipp.
Tilhengere av geoingeniør betraktes som SO 2som et middel for å stoppe den globale oppvarmingen, for å "klimatisere" planeten. Denne metoden ble forlatt fordi den også kunne få dramatiske konsekvenser. Faktisk når svoveldioksid kombineres med vann og atmosfærisk oksygen som forårsaker surt regn , som forstyrrer eller til og med ødelegger skjøre økosystemer. Svoveldioksid , sammen med nitrogendioksid, er en av hovedårsakene til surt regn. I tillegg SO 2fører til forsuring av havene, noe som risikerer eksistensen av plankton, dyr med kalkholdige skjell og korallrev. Imidlertid produserer planktoner halvparten av det terrestriske oksygenet som trengs av mennesker og dyr.
Luftforurensende stoff
Svoveldioksid har vært en av de viktigste forurensningene i atmosfæren siden starten på den industrielle revolusjonen , på grunn av de store mengdene kull, deretter olje og gass som ble brent av mennesker, hovedsakelig på den nordlige halvkule . Det har betydelige effekter på folkehelsen .
I tillegg nedbryter konsentrasjonen av svoveldioksid i luften økosystemene: det er en kronisk forsurer av nedbør, og forsuring av jord og sedimenter fremmer utslipp av giftige metaller (tungmetaller, metalloider, radionuklider, etc. ) samt deres biotilgjengelighet. .
Svoveldioksidutslipp er (sammen med nitrater ) forløpere for surt regn, men de bidrar også til dannelsen av atmosfæriske aerosoler som endrer klimaet betydelig. I stor grad takket være programmet Acid Rain Program (in) fra Environmental Protection Agency , var USA blant de største utslippene som registrerte en 33% reduksjon fra 2002 til 1983. Denne forbedringen skyldtes hovedsakelig røykgassavsvovling, en teknologi som tillater svovel som skal utvinnes fra røykgassene fra kull og petroleumskraftverk, spesielt ved å reagere den med kalk for å danne kalsiumsulfitt:
CaO + SO 2→ CaSO 3Aerob oksidasjon av CaSO 3gir CaSO 4, anhydrid .
Det meste av gips som selges i Europa kommer nå fra røykgassavsvovling.
I en industriell kjele med fluidisert seng kan svovel fjernes fra kullet på forbrenningstidspunktet ved å tilsette kalkstein som et materiale i sengen. Dette blir referert til som "fluidbed bed forbrenning".
Svovel kan også fjernes fra visse drivstoff (olje, gass) allerede før forbrenning, noe som forhindrer dannelsen av SO 2når drivstoffet blir brent og beskytter installasjonene mot de etsende effektene av svovel. Den Claus-prosessen benyttes i raffinerier for å produsere svovel som et biprodukt . Stretford-prosessen har også blitt brukt til å fjerne svovel fra drivstoff. Prosessene basert på en redoksreaksjon basert på jernoksider kan endelig brukes, for eksempel "Lo-Cat" -prosessen.
Den obligatoriske bruken av svovelfri drivstoff til visse bruksområder gjorde det mulig å redusere mengdene som ble sluppet ut i luften fra 1970-tallet, men unntak gitt til sjøtransport og visse næringer forklarer utslippene som fortsatt er høye. Også ved begynnelsen av XXI - tallet forblir Kina og India, ved å brenne store mengder kull, store utslipp av svovelgasser. Visse drivstofftilsetningsstoffer (f.eks. Basert på kalsium og magnesiumkarboksylat) kan brukes i marine motorer for å redusere svoveldioksidutslipp i atmosfæren.
I 2006 var Kina verdens største svoveldioksidforurenser, hovedsakelig for å produsere forbruksvarer til bruk i andre land (”grå utslipp”). I 2005 ble kinesiske utslipp estimert til 23,1 Mt , nesten sammenlignbare med de i USA i 1980, og økte kraftig (vekst på over 27% på fem år fra 2000 til 2005). For å mindre lide av syrefallet fra Kina, bestemte Japan seg i 2007 for å hjelpe det med å utvikle rene energier .
I næringsmiddelindustrien
Det er mye brukt i mat og agribusiness og finnes hovedsakelig i:
- viner, hovedsakelig rosé og hvite, som har mindre tanniner enn rødviner og derfor gjennomgår sterkere oksidasjon. Svoveldioksid gjør det mulig å redusere dette;
- eddik;
- tørket frukt;
- kjøtt, gelé brukt i kjøttpålegg, øl og andre gjærede drikker;
- konfekt, syltetøy, kandiserte frukter, gelé, syltetøy, sirup osv.
I vinifisering
I vin er svoveldioksid til stede i hydrert fri form: H 2 SO 3eller svovelsyre , som kombinerer 2/3 med bestanddeler av vin. Vi har altså SO 2totalt = SO 2gratis + SO 2 kombinert.
En del av den gratis delen fungerer som en beskytter av vinen mot ødeleggelsesmikroorganismer. Denne delen kalles SO 2aktiv eller SO 2molekylær. SO 2kan være i kombinert form med aldehyder (etanol), ketoner (alfa-ketoglutarsyre) og visse sukkerarter for å gi en stabil forbindelse. Kroppen dannet ved kombinasjon mellom svoveldioksid og ethanal er aldehyd-svovelsyre eller etanolsulfonsyre, som er en sterk syre , ifølge følgende reaksjon:
CH 3 CHO + NaH SO 3 → CH 3 CHOH-O-SO 2 NaAvhengig av dose hemmer eller stopper svoveldioksid utviklingen av gjær og bakterier , som kan brukes til mutasjon av søte eller sirupsviner, eller bare for å sikre bevaring av vinen. Under vinfremstillingen gjør innføringen av svoveldioksid det mulig å velge gjær av arten Saccharomyces cerevisiae som er mer motstandsdyktig mot svoveldioksid enn gjær fra andre slekter som Pichia anomala (en) (syn. Hansenula ). Det finnes forskjellige analysemetoder for å måle SO 2 i viner.
Helse og regulering
Svoveldioksid eller E220 vil forårsake helsefare i følgende tilfeller:
- under innånding;
- ved inntak;
- ved kontakt med hud og slimhinner.
Under inntaket er det mer sannsynlig at organene som har de høyeste sulfittoksydaseaktivitetene, avgifter det gjennom urinen. Persistensen av SO 2- derivaterkan vurderes av et overdreven inntak. For brukeren er sulfitter veldig kraftige nukleofiler som ikke gir akutt toksisitet, men kan forårsake sterke eller alvorlige allergier. Det ødelegger vitamin B 1 (eller tiamin ) rundt pH = 6, kan forårsake mageirritasjon, som skal unngås hos nyrepasienter. Dermed er ADI etablert av WHO 0,7 mg kg -1 kroppsvekt per dag.
I de fleste tilfeller vises symptomene noen minutter etter inntak av mat som inneholder sulfitter. Luftforurensning med SO 2ville også spille en rolle i utseendet til disse reaksjonene av intoleranse. I tillegg er personer med astma mye mer følsomme enn den gjennomsnittlige personen.
Europeiske forskrifter forplikter nå produsenter til å indikere "Inneholder sulfitter" hvis det er i en konsentrasjon på mer enn 100 mg l −1 . I Canada begrenser SAQ konsentrasjonen til 50 ppm svoveldioksid i fri tilstand og 300 ppm svoveldioksid i kombinert tilstand.
I den nåværende sammenhengen hvor respekt for miljøet og økologiske matvarer blir mer og mer anbefalt, har vinavlere og til og med forbrukere en tendens til å vende seg til økologiske viner med SO 2-innhold.er mindre, men for hvilke bruken av SO 2forblir autorisert. Merk at, i forhold til andre land i verden (Canada, Sveits eller USA), er SO 2- innlemmelsesregleneunder vinproduksjon er mye mer restriktive, enda strengere i Europa. Produsenter av naturlige viner har som mål å redusere tilsetning av svoveldioksid så mye som mulig.
Følgende tabell viser de bemerkelsesverdige forskjellene i SO 2 -konsentrasjoner totalt i disse forskjellige landene:
| SO 2 i mg / l | NOP (USA) “ Laget med økologiske druer ” SO 2 Total |
Bio Canada | Sveitsisk knopp | Demeter SO 2 totalt (5 år) |
|---|---|---|---|---|
| Tørr rød (sukker < 5 g l −1 ) |
100 | 100 | 120 | 70 |
| hvit / tørr rosé (sukker < 5 g l −1 ) |
100 | 100 | 120 | 90 |
| hvit / tørr rosé (sukker < 5 g l −1 ) |
100 | 150 | 170 | 70 |
| Hvit / rosé (sukker> 5 g l −1 ) |
100 | 150 | 170 | 130 |
| Likørvin (sukker> 5 g l −1 ) |
100 | 250 | 170 | 80 |
Store hendelser i Frankrike
De 22. juni 2011i 7 timer 45 , et teknisk problem ved stenging av en ventil ved raffineriet Feyzin (som tilhører gruppen Total ) la ut en stor svoveldioksidsky skyvet av en sørlig vind over Lyon . Flere personer ble innlagt på sykehus og virksomheter evakuert.
Den prefekturet , som forsøkte å berolige befolkningen, anbefales "å lufte boliger og kontorer" , og dermed gi instruksjoner motsatt de av brannmenn som rådet folk til å "bo hjemme og lukke vinduene" .
Merknader og referanser
- SULFUR DIOXIDE , sikkerhetsark (er) til det internasjonale programmet for kjemisk sikkerhet , konsultert 9. mai 2009.
- (i) David R. Lide, håndbok for kjemi og fysikk , Boca Raton, CRC,16. juni 2008, 89 th ed. , 2736 s. ( ISBN 978-1-4200-6679-1 ) , s. 9-50.
- (en) Yitzhak Marcus, The Properties of Solvents , vol. 4, England, John Wiley & Sons,1999, 239 s. ( ISBN 0-471-98369-1 ).
- beregnede molekylmasse fra " atomvekter av elementene 2007 " på www.chem.qmul.ac.uk .
- (no) Robert H. Perry og Donald W. Green , Perrys Chemical Engineers 'Handbook , USA, McGraw-Hill,1997, 7 th ed. , 2400 s. ( ISBN 0-07-049841-5 ) , s. 2-50.
- (in) " Properties of Various Gases " på flexwareinc.com (åpnet 12. april 2010 ) .
- (in) W. M Haynes, Handbook of Chemistry and Physics , CRC, 2010-2011 91 th ed. , 2610 s. ( ISBN 9781439820773 ) , s. 14-40.
- (i) Irvin Glassman og Richard A. Yetter, forbrenning , Amsterdam / Boston, Elsevier,2008, 4 th ed. , 773 s. ( ISBN 978-0-12-088573-2 ) , s. 6.
- (in) David R. Lide, CRC Handbook of Chemistry and Physics , CRC Press,2009, 90 th ed. , 2804 s. , Innbundet ( ISBN 978-1-4200-9084-0 ).
- (i) David R. Lide, håndbok for kjemi og fysikk , Boca Raton, CRC,2008, 89 th ed. , 2736 s. ( ISBN 978-1-4200-6679-1 ) , s. 10-205.
- “Svoveldioksid , ” på ESIS (åpnet 13. februar 2009).
- IARC arbeidsgruppe for evaluering av kreftfremkallende risikoer for mennesker , “ Global Carcinogenicity Assessments for Humans, Group 3 : Uklassifiserbar med hensyn til deres kreftfremkallende effekt for mennesker ” , på monographs.iarc.fr , IARC,16. januar 2009(åpnet 22. august 2009 ) .
- Indeksnummer i tabell 3.1 i vedlegg VI til EF-forskrift nr . 1272/2008 [PDF] , 16. desember 2008.
- " Svoveldioksid " i databasen over kjemikalier Reptox fra CSST (Quebec-organisasjonen med ansvar for arbeidsmiljø og helse), åpnet 23. april 2009.
- (in) " Sulphur dioxide " på hazmap.nlm.nih.gov (åpnet 14. november 2009 ) .
- (i) AF Holleman og E. Wiberg, " Inorganic Chemistry ", Academic Press , San Diego, 2001 ( ISBN 0-12-352651-5 ) .
- (i) Norman N. Greenwood og A. Earnshaw, " Chemistry of Elements ", Butterworth-Heinemann 2 e ed. , s. 700 , Oxford, 1997 ( ISBN 0-08-037941-9 ) .
- (in) David R. Lide, CRC Handbook of Chemistry and Physics , CRC Press,2009, 90 th ed. , 2804 s. , Innbundet ( ISBN 978-1-4200-9084-0 ) , s. 6-105.
- Stephen Selv et al. , The Atmospheric Impact of the 1991 Mount Pinatubo Eruption , Fire and Mud: Eruptions and Lahars of Mount Pinatubo, Philippines, 1997
- Svoveldioksid , EPA
- Hogan, C. Michael, “Abiotic factor” i Encyclopedia of Earth , 2010, Emily Monosson og C. Cleveland (red.), National Council for Science and the Environment, Washington DC.
- (i) Michael R. Lindeburg , Mechanical Engineering referansemanualen for PE eksamen , Belmont, CA, Professional Publications, Inc.2006, 1296 s. ( ISBN 978-1-59126-049-3 ) , s. 27–3.
- Vanlige spørsmål om fjerning og gjenvinning av svovel ved bruk av LO-CAT Hydrogen Sulfide Removal System . gtp-merichem.com
- Analyse av prosessscreening av alternativ gassbehandling og svovelfjerning for forgassing [PDF] , desember 2002, rapport av SFA Pacific, Inc. utarbeidet for US Department of Energy (åpnet 31. oktober 2011).
- Mai, Walter R., Marine Emissions Abatement , SFA International, Inc., s. 6 .
- Kina har den verste tiden med surt regn , United Press International , 22. september 2006.
- Michel Temman, "Ofre for avvisning, Tokyo hjelper Beijing med å bli grønn", Liberation , 16. april 2007, [ les online ] .
- Canadian Center for Occupational Health and Safety .
- Les online .
- Les online .
- Organiske regler for vinfremstilling i Frankrike og i utlandet [PDF] , på milleime-bio.com .
- Les online .
- Les online .
- Les online , på 20minutes.fr .