Bisfosfoglyseratmutase
| Bisfosfoglyseratmutase
|

Humant bisfosfoglyseratmutasedimer ( PDB 2H4Z )
|
| Hovedtrekkene |
|---|
| Symbol
|
BPGM
|
|---|
|
|
EF nr.
|
5.4.2.4
|
|---|
| Homo sapiens |
|---|
|
|
Locus
|
7 q 33
|
|---|
|
Molekylær vekt
|
30 005 Da
|
|---|
| Antall rester
|
259 aminosyrer
|
|---|
|
|
Koblinger tilgjengelig fra GeneCards og HUGO .
|
|
Kom inn
|
669
|
|---|
|
HUGO
|
1093
|
|---|
|
OMIM
|
613896
|
|---|
|
UniProt
|
P07738
|
|---|
|
RefSeq ( mRNA )
|
NM_001293085.1 , NM_001724.4 , NM_199186.2 , XM_011516527.1
|
|---|
|
RefSeq ( protein )
|
NP_001280014.1 , NP_001715.1 , NP_954655.1 , XP_011514829.1
|
|---|
|
|
Sammen
|
ENSG00000172331
|
|---|
|
FBD
|
1T8P , 2A9J , 2F90 , 2H4X , 2H4Z , 2H52 , 2HHJ , 3NFY
|
|---|
|
|
GENATLAS • Genetests • GoPubmed • HCOP • H-InvDB • Treefam • Vega
|
|
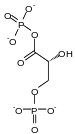
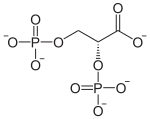
Den bisphosphoglycerate mutase (BPGM) er et enzym som er spesifikt for erytrocytter og celler i placenta å katalysere isomerisering av 1,3-bisphospho- D -glycérate (1,3-BPG) som produseres under glykolyse i 2,3-bisphospho - D -glycerate , som har den egenskap å stabilisere den deoksy formen av hemoglobin og derfor for å gjøre mer effektiv transport av oksygen i blodet under lavt partialtrykk av O to ved å tilpasse affinitetskurven deretter.
Denne reaksjonen er fysiologisk nyttig bare i nærvær av hemoglobin , hvor 2,3-BPG har den effekten at den forårsaker frigjøring av oksygen bundet til oksyhemoglobin ved å stabilisere deoksyhemoglobin. Dette er grunnen til at BPGM bare finnes i erytrocytter og morkaken : i sistnevnte gjør det det mulig å tilveiebringe større mengder oksygen til fosteret .
Bisfosfoglyseratmutase
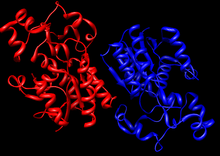
Krystallinsk struktur av en
dimer av human bisfosfoglyseratmutase (
PDB 1T8P ).
Referanser
-
Verdiene for massen og antallet rester som er angitt her, er verdiene til proteinforløperen som er resultatet av translasjonen av genet , før posttranslasjonelle modifikasjoner , og kan avvike betydelig fra de tilsvarende verdiene for funksjonelt protein .
-
(en) Wang Y, Wei Z, Bian Q, Cheng Z, Wan M, Liu L, Gong W, " Crystal structure of human Bisphosphoglycerate mutase " , J. Biol. Chem. , vol. 279, nr . 37,
September 2004, s. 39132–8 ( PMID 15258155 , DOI 10.1074 / jbc.M405982200 )

 Krystallinsk struktur av en dimer av human bisfosfoglyseratmutase ( PDB 1T8P ).
Krystallinsk struktur av en dimer av human bisfosfoglyseratmutase ( PDB 1T8P ).
