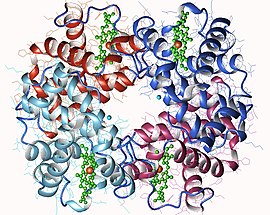
Hemoglobin
Den hemoglobin , vanligvis symbolisert Hb , og til Hgb er en respiratorisk pigment (molekylfamilien metalloproteiner , her inneholdende jern ) som er tilstede hovedsakelig i blodet av virveldyr , i deres røde blodceller og i de vev noen av virvelløse dyr . Dens funksjon er å transportere oksygen O 2fra luftveiene ( lunger , gjeller ) til resten av kroppen . Mengden hemoglobin er en parameter målt under en blodtelling .
Roll
Hemoglobin frigjør oksygen i vev for aerob cellulær respirasjon , som gjennom metabolisme gir energi til biologiske prosesser som er livsviktige.
Hos mennesker er hemoglobin et protein hetero - tetrameric dannet fra peptidkjeder er identiske to og to. Hemoglobin A (HbA) representerer omtrent 95% av hemoglobinmolekylene hos voksne, bestående av to α-kjeder og to β-kjeder; Det er også et hemoglobin A 2 (HbA 2 ) med formel α 2 δ 2, Og et hemoglobin F (HbF, føtal) med formel a 2 γ 2. Hver av de fire kanalene er forbundet med en prostetisk gruppe som kalles heme og som består av et kation av jern kompleksdannet med et porfyrin . Hemoglobin er derfor et hemoprotein .
Hos pattedyr utgjør hemoglobin nesten 96% av tørrstoffmassen til røde blodlegemer, og omtrent 35% av det totale innholdet inkludert vann. Hvert hemoglobinmolekyl kan binde opptil fire oksygenmolekyler O 2, og hemoglobinet i blodet kan bære 1,34 ml O 2per gram protein, som gjør at den kan bære 70 ganger mer oksygen enn mengden O 2oppløst i blod. Hemoglobin er også involvert i transport av andre gasser enn oksygen. Spesielt sikrer den transport av en del av karbondioksidet CO 2produsert av cellulær respirasjon, og også transporterer nitrogenoksyd NO, som spiller en betydelig rolle i cellulær signalisering av visse fysiologiske prosesser , og som er utgitt sammen med oksygen etter å ha blitt transportert på en tiol gruppe av apoprotein .
mesteparten av hemoglobinet finnes i røde blodlegemer, som selv produseres av benmargen. Imidlertid er ikke alt hemoglobin konsentrert i røde blodlegemer. Det er således funnet for eksempel i dopaminerge nevroner i A9-gruppen av substantia nigra , i makrofager , i alveolære celler og i nyrene i mesangiumceller . I disse vevene spiller hemoglobin en antioksidant rolle og en regulator av jernmetabolisme .
Hemoglobin og forskjellige relaterte molekyler er også til stede i et stort antall virvelløse dyr, sopp og planter . I disse organismer er funksjonen til hemoglobin å transportere oksygen O 2, men kan også fungere som transportør og regulator av andre kjemiske arter som karbondioksid CO 2, Nitrogenmonoksyd NO, hydrogensulfid HS og sulfid anion S 2- . En variant av hemoglobin, kalt leghemoglobin , fjerner oksygen fra anaerobe systemer , for eksempel Rhizobium nodules in fabaceae , før den inaktiverer dem.
Struktur og drift
Underenheter
Hemoglobin har en kvartær struktur som er karakteristisk for mange proteiner med kuleformede underenheter . De fleste av dets rester av aminosyrer er involvert i α-helixer forbundet med ikke-spiralformede segmenter. De skruelinjeformede seksjoner stabiliseres ved hydrogenbindinger som gir proteinet dens karakteristiske tredimensjonale struktur, kalt globin folding som den er også funnet i andre globiner med en heme prostetisk gruppe, slik som myoglobin . Denne karakteristiske brettingen har et hulrom der det er tett inn et hem- molekyl som utgjør den protetiske gruppen av proteinet. Hemoglobin inneholder derfor ett hem-molekyl per underenhet.
-
Generisk fremstilling av et hemoglobinmolekyl, som viser de fire underenhetene, identiske parvis, hver med et hemmolekyl satt inn i hulrom i underenhetene.
Hos de fleste virveldyr er hemoglobinmolekylet en samling av fire kuleformede underenheter i et omtrent tetraedrisk arrangement . Disse underenhetene holdes sammen av hydrogenbindinger, av ioniske bindinger og av hydrofob effekt . Hos voksne mennesker er den vanligste typen hemoglobin hemoglobin A, som består av to α-underenheter og to β-underenheter, som hver består av henholdsvis 141 og 146 aminosyrerester. Denne strukturen er symbolisert med α 2 β 2. Disse underenhetene er strukturelt veldig like og har omtrent samme størrelse. Hver har en molekylvekt på ca. 16 kDa , eller 64 kDa ( 64 458 g · mol -1 ) for proteinet i full lengde. Hos barn kalles hovedhemoglobinet hemoglobin F (foster), med formel α 2 γ 2idet γ-kjedene gradvis erstattes av β-kjeder under vekst.
Heme
Heme er sammensatt av et kation av jern ( II ) koordinert til fire atomer av nitrogen fra et porfyrin , et tetrapyrrol molekylet er plane. Denne Fe2 + -kationen er også kovalent bundet til histidin F8- resten av globinet der hemmen er satt inn; denne resten, kalt proksimal histidin , er plassert under hemets plan. Fe 2+ kan også bindes reversibelt gjennom en koordinerende kovalent binding til et oksygenmolekyl O toover den heme plan, motsatt den proksimale histidin, fullfører den seks- liganden oktaedrisk koordinering geometrien av den jern ( II ) kation i oxyhemoglobin; i fravær av oksygen, i deoksyhemoglobin, er dette sjette området okkupert av en meget svakt bundet vann molekyl .
Den toverdig jern i deoksyhemoglobin er i en høy spinntilstand , det vil si at dens fem dager orbitaler er opptatt, i hovedsak av enkle elektroner, derav en ioneradius i størrelsesorden 92 pm , mens det i oxyhemoglobin, er toverdig jern i en lav spinntilstand , det vil si dets d orbitaler er okkupert av seks parede elektroner som er begrenset til de tre laveste energi-orbitaler, derav en ioneradius på bare 75 pm . Av denne grunn forskyves Fe2 + -ionen ca. 40 um fra hemets plan i deoksyhemoglobin, men bare 10 um i oksyhemoglobin. Denne variasjonen er i bunnen av bryteren mellom anspent form og avslappet form av hemoglobin.
- Struktur av hem b , protesegruppe av hemoglobin.
-
(no) Skjematisk diagram over bindingen av et oksygenmolekyl O 2på hem , symbolisert her med en tykk strek. Den superoksyd ion O to• - resulterende er knyttet på den ene siden til kationen av jern ( III ) ved en koordinat kovalent binding og den andre siden til histidindistalen . Fe ( II ) kation av deoksyhemoglobin er i den høye spinntilstand og forskyves ut av hemen plan mot den proksimale histidin, men er brakt tilbake i dette plan ved å sende til den lave sentrifuge tilstand ved binding til l. Oksygen, som skift histidinet proksimalt til hem og fremmer forskyvningen av resten av proteinet fra den anstrengte (T) formen til den avslappede (R) formen.
Jernkationen kan være i oksidasjonstilstand +2 eller +3: i sistnevnte tilfelle har vi å gjøre med metemoglobin , som binder seg til oksygen mindre reversibelt enn hemoglobin, og med lavere affinitet. Faktisk, når det binder seg til jernholdig hem, oksygenmolekylet O 2en tendens til å bli redusert til superoxyd ion O to• - mens Fe 2+ -kationen har en tendens til å bli oksidert til Fe 3+ , en mekanisme som er reversert under frigjøring av oksygen; derimot er binding av oksygen til ferrihem i det vesentlige irreversibel og har en tendens til å blokkere R-form protein, som forhindrer frigjøring av oksygen og hemmer oksygentransportørfunksjonaliteten. Den cytokrom b 5 reduktase , eller methemoglobin reduktase er det enzymet som sikrer reduksjon av methemoglobin funksjonelt hemoglobin ved reduksjon av kationet Fe 3+ til Fe 2+ , slik at det er et essensielt enzym for å opprettholde egenskapene til blod.
Stram form (T) og avslappet form (R)
Deoksygenert hemoglobin (deoksyhemoglobin) har en såkalt T, eller anspent konformasjon , mens oksygenert hemoglobin (oksyhemoglobin) har en såkalt R, eller avslappet konformasjon . T-formen har lav affinitet for oksygen og har derfor en tendens til å frigjøre den, mens R-formen har høy affinitet for oksygen og har en tendens til å binde den. Flere faktorer favoriserer den ene eller den andre av disse konformasjonene. Således er T formen foretrekkes av en lav pH ( sur ), en høy konsentrasjon av CO 2og et høyt nivå av 2,3-bisfosfoglyserat (2,3-BPG), som fremmer frigjøring av oksygen når blodet sirkulerer gjennom vevet , mens R-formen favoriseres av en høy pH, et lavt partialtrykk av CO 2og et lavt nivå på 2,3-BPG, som fremmer opptaket av oksygen når blodet sirkulerer på nivået av lungealveolene .
-
Skjematisk fremstilling av byttet av hemoglobin mellom T (deoksy) og R (oksy) former. Bevegelsene av heme og av den proksimale histidin er klart synlig i den α 1 og S 2 subenheter .
-
O 2 metningshastighethemoglobin som en funksjon av partialtrykket av O to ; noen ganger kalt Barcroft- kurven , er den sigmoid på grunn av den samarbeidseffekten som følger med binding av oksygen til hemoglobin.
Vekslingen mellom T-form og R-form av hemoglobin er en såkalt samarbeidsmekanisme , det vil si allosterisk , fordi binding av et oksygenmolekyl til T-formen induserer en konformasjonsendring som forplanter seg delvis til tilstøtende underenheter , hvis affinitet for oksygen øker gradvis når andre oksygenmolekyler binder seg til hemoglobin, til alt proteinet antar R-konformasjonen; omvendt, frigjøring av et oksygenmolekyl fra R-formen induserer en konformasjonsendring som delvis forplanter seg til tilstøtende underenheter, hvis affinitet for oksygen gradvis avtar når hemoglobinet frigjør oksygen, til alt proteinet adopterer T-konformasjonen. Dette er grunnen til at kurven for oksygenbinding til hemoglobin som en funksjon av oksydens delvise trykk viser en sigmoid form , mens det ville være hyperbolisk i fravær av allosteria.
Hemoglobin oksygenmetningskurve
Det er vanlig å plotte metningshastigheten av hemoglobin i oksygen O 2representert på y-aksen som en funksjon av partialtrykket av oksygen O 2, gitt på abscissen . I denne representasjonen er kurven sigmoid og har en tendens til å skyve til venstre når affiniteten til hemoglobin for oksygen øker, og til høyre når den avtar. Deltrykket av oksygen der hemoglobin er 50% mettet med oksygen kalles p 50 : jo lavere verdi, desto høyere affinitet har hemoglobin for oksygen. Som en veiledning er p 50 av hemoglobin hos en sunn voksen typisk 3,5 kPa , ofte skrevet 26,6 mmHg , mens myoglobin typisk er 130 Pa .
Flere faktorer øker p 50 og skyver derfor denne kurven til høyre:
- et fall i pH , som blir surt : dette er Bohr-effekten ;
- en økning i nivået av karbondioksid CO 2 : dette er Haldane-effekten ;
- en økning i nivået av 2,3-bisfosfoglyserat (2,3-BPG);
- en temperaturøkning, men med en relativt liten effekt.
Disse effektene er reversible, og å reversere variasjonen i disse faktorene får kurven til å gli til venstre.
Andre ligander som bæres av hemoglobin
Foruten oksygen O 2, som binder seg til hemoglobin i en såkalt samarbeidsmekanisme , transporterer dette proteinet også andre ligander , hvorav noen er konkurransedyktige hemmere , slik som karbonmonoksid CO, og andre er allosteriske ligander som karbondioksid CO 2og nitrogenmonoksid NO. CO 2reversibelt binder seg til amingrupper i apoprotein for å danne carbaminohemoglobin , som er tenkt å tilveiebringe omtrent 10% av CO 2 transport hos pattedyr , resten blir hovedsakelig transportert i form av HCO 3- bikarbonationer- . Nitrogenoksid binder reversibelt til tiolgruppene i apoproteinet for å danne en S- nitrosotiol . Det er mulig at nitrogenoksydtransport medierer transport av oksygen med hemoglobin indirekte ved å fungere som en vasodilator i vev der oksygenpartiet er lavt.
Hemmere ved konkurranse med oksygenBindingen av oksygen til hemoglobin blokkeres effektivt av karbonmonoksid CO, for eksempel fra sigarettrøyk , eksos eller ufullstendig forbrenning av en kjele . Karbonmonoksid konkurrerer med oksygen på sistnevntes bindingssted på hem. Den affinitet til hemoglobin for karbonmonoksyd er 230 ganger større enn den til hemoglobin for oksygen, slik at små mengder av karbonmonoksid er tilstrekkelig til å redusere oksygenering av hemoglobin i hematosis , og dermed evnen til blodet oksygenering av legemet. Den hypoksi som således resulterer fra kontinuerlig eksponering til 0,16% CO i luft fører til svimmelhet , kvalme , hodepine og takykardi i løpet av 20 minutter, og fører til død i løpet av to timer; 1,28% CO i luften forårsaker bevisstløshet etter bare to til tre pust, og død på mindre enn tre minutter. Når det kombineres med karbonmonoksid, er hemoglobin et protein som kalles karbokshemoglobin, hvis veldig knallrøde farge sannsynligvis vil fargelegge huden rosa av ofre som døde av karbonmonoksidforgiftning , som ellers ville ha fargen blek eller blå.
Tilsvarende hemoglobin oppviser ved sitt oksygenbindingssete, en konkurransedyktig affinitet for cyanid -ion CN - , svovelmonoksid SO, og sulfid- ion S 2 , som med . Sulfid hydrogen H 2 S. Disse binder seg til jernkationen av hem uten å endre oksidasjonstilstanden, men de hemmer likevel oksygenbinding til hem, derav deres høye toksisitet.
Allosteriske hemoglobinliganderDen karbondioksid CO 2binder lettere til deoksyhemoglobin, som letter eliminering fra kroppen. Dette kalles Haldane-effekten .
I tillegg CO 2oppløst i blodet blir omdannet til bikarbonat -anion HCO 3- av karbonanhydrase , avhengig av reaksjonen:
CO 2+ H 2 O→ H 2 CO 3→ HCO 3- + H + .Det følger at blodet rik på CO 2er også surere , dvs. pH-verdien senkes av effekten av karbonsyre . Bindingen av H + protoner og CO 2 -molekylerhemoglobin induserer en konformasjonsendring som favoriserer T-formen, og derfor frigjøring av oksygen. Protoner binder seg til forskjellige steder i hemoglobin, mens karbondioksid binder seg til α- aminogrupper for å danne karbaminohemoglobin . Nedgangen i affiniteten til hemoglobin for oksygen i nærvær av CO 2og sur pH kalles Bohr-effekten .
Mennesker som er akklimatisert til høye høyder, har et økt blodnivå på 2,3-bisfosfoglyserat (2,3-BPG). Sistnevnte er en heteroallosterisk effektor som har den effekten at hemoglobinets affinitet for oksygen reduseres ved å stabilisere T-formen: under et delvis oksygentrykk enn ved havnivå har en nedgang i hemoglobins affinitet for oksygen effekten total effektivitet av oksygentransport med hemoglobin. Mer generelt observeres en økning i nivået av 2,3-BPG når partialtrykket av oksygen synker i perifere vev, for eksempel i tilfelle hypoksemi , kronisk luftveissykdom , anemi eller til og med hjertesvikt . Omvendt synker nivået av 2,3-BPG i tilfelle septisk sjokk og hypofosfatemi (in) .
Biosyntese og nedbrytning
Biosyntese av hemoglobin innebærer et komplekst trinn. Den heme er fra en serie av reaksjoner som begynner i mitokondriene og er videreført i det cytosolen av erytrocytter umodne, mens den apoprotein fremstilles ved ribosomer cytosol. Hemoglobinproduksjon forekommer i de tidlige stadiene av erytropoiese , fra proerythroblast- stadiet til retikulocyttstadiet i benmargen . Det er her pattedyrs erytrocytter mister kjernen , mens kjernen forblir i erytrocytter hos fugler og mange andre arter . Den biosyntese av apoprotein fortsetter imidlertid etter tapet av kjernen, fordi det som er igjen av messenger-RNA i cellen, noe som kan oversettes ved ribosomene til cytosol til aktivering av erytrocytt i apparatet. Kardiovaskulære .
Hos vertebrater fjernes erytrocytter som har nådd slutten av livet på grunn av senesens eller forverring fra blodet ved fagocytose ved makrofager i milten og i leveren . I tilfelle hemolyse i blodet binder hemoglobin til haptoglobin , mens fritt hem er bundet av hemopexin , noe som begrenser den oksidative effekten. Det ufullstendig nedbrutte eller hemoglobinet som frigjøres i store mengder fra skadede røde blodlegemer, vil sannsynligvis tette blodårene , slik som kapillærer i nyrene , noe som kan forårsake nyresykdom . Det frigjorte hemoglobinet blir eliminert fra blodet av CD163- proteinet , som eksklusivt uttrykkes i monocytter og makrofager. Hemoglobin brytes ned i disse cellene og hemejern resirkuleres, mens ett molekyl karbonmonoksid frigjøres per nedbrutt hememolekyl: nedbrytning av hem er en av få naturlige prosesser. Produserer karbonmonoksid i menneskekroppen og er ansvarlig for tilstedeværelse av CO i blodet fra mennesker som puster selv den reneste luften. Denne prosessen danner biliverdin , deretter bilirubin , som er gul i fargen. Uoppløselig frigjøres det av makrofager i blodplasmaet , hvor det binder seg til serumalbumin , som transporterer det til hepatocytter . Sistnevnte løser det ved konjugering med glukuronsyre og utskiller det i tarmene med gallen . Tarmene metaboliserer bilirubin til urobilinogen , som skilles ut i avføringen som stercobilin så vel som i urinen . Når bilirubin ikke kan skilles ut, øker konsentrasjonen i blodet, og det elimineres hovedsakelig gjennom urinen, som blir mørk mens avføringen misfarges.
Jernet produsert ved nedbrytning av hem lagres i ferritiner i vevet og transporteres i blodplasmaet av β-globuliner slik som transferriner .
Genetisk
Hemoglobinmolekyler består av underenheter type globin hvis sekvens varierer avhengig av art . Det er også varianter av hemoglobiner innen samme art, selv om en av disse variantene vanligvis er stort sett dominerende over de andre. Hos mennesker kalles den dominerende formen for hemoglobin hemoglobin A; den er kodet av HBA1- , HBA2- og HBB- gener lokalisert på kromosom 16 for de to første og på kromosom 11 for det siste.
Utvikling
Det er generelt akseptert at forskjellen mellom hemoglobin og myoglobin er etter separasjon av gnathostomes ( virveldyr til kjeve ) av med lamprey . Myoglobin har vært rettet mot lagring av oksygen mens hemoglobin har spesialisert seg på transport av oksygen. Underenhetene til proteinet er kodet av gener av α- og β- globin- typen . Forgjengerne til disse genene oppstod under en duplisering som skjedde etter at gnathostomer dukket opp, for rundt 450 til 500 millioner år siden. Utseendet til α- og β-gener åpnet veien for polymerisasjonen av disse globinene, og derfor for dannelsen av et større protein bestående av forskjellige underenheter . Det faktum at hemoglobin er et polymert protein er grunnlaget for den allosteriske mekanismen som særlig ligger til grunn for den kooperative naturen til oksygenbinding til hemoglobin. A-genet har deretter gjennomgått en annen duplisering som fører til dannelsen av HBA1- og HBA2- gener . Disse flere duplikasjoner og avvik har skapt et helt sett med gener relatert til α- og β-globiner, hvis regulering fører til at de kommer til uttrykk på forskjellige utviklingsstadier.
-
Justering av α, β og δ kjedesekvenser av humant hemoglobin (kilde UniProt ).
Mutasjoner
De mutasjoner av genene for hemoglobin kan føre til hemoglobinvarianter. De fleste av disse variantene er funksjonelle og har ingen helseeffekt. Noen mutasjoner i hemoglobin kan derimot forårsake genetiske sykdommer som kalles hemoglobinopatier . Den mest kjente av disse tilstandene er sigdcelleanemi , som var den første menneskelige sykdommen hvis mekanisme ble belyst på molekylært nivå. De thalassemias er en annen gruppe av hemoglobinopatier som involverer en endring av genregulering av betaglobin del av hemoglobin. Alle disse sykdommene resulterer i anemi .
Endring av aminosyresekvensen til hemoglobin kan være adaptiv. Det var derfor mulig å vise at hemoglobin tilpasser seg til det fall i partialtrykket av oksygen ble observert i stor høyde. Hemoglobinet må da være i stand til å binde seg til oksygen ved et lavere trykk, noe som kan manifestere seg ved en endring i sekvensen av aminosyrene som er involvert i affiniteten til hemoglobin for oksygen., Som det har blitt observert for eksempel i kolibrier i Andesfjellene. Cordillera : Således, i arter av slekten Oreotrochilus , i Castelneau kolibri , inca violifera eller til og med den gigantiske kolibrien , reduserer disse mutasjonene affiniteten til hemoglobinet for fytinsyre , som i disse fuglene spiller den samme rollen som 2,3- bisfospoglyserat hos mennesker; denne reduksjonen i affinitet har den virkning at den øker effektiviteten til oksygentransport når partialtrykket til sistnevnte reduseres.
Tilpasningen av hemoglobin til store høyder påvirker også mennesker. Vi identifiserte dermed en gruppe tibetanske kvinner hvis genotype koder for et hemoglobin hvis affinitet for oksygen økes ved lavt partialtrykk. Dette har den effekten at barnedødeligheten reduseres under disse ekstreme forholdene, noe som gir en selektiv fordel som favoriserer individer som bærer disse hemoglobinmutasjonene.
Menneskelige varianter av hemoglobin
Hos voksne er hovedvarianten av hemoglobin hemoglobin A , eller HbA , med formelen α 2 β 2, som utgjør over 97% av det totale hemoglobinet til en sunn voksen. Den andre varianten av voksen hemoglobin er hemoglobin A 2 , eller HbA 2 , med formelen α 2 δ 2, som representerer mellom 1,5% og 3,1% av totalt hemoglobin hos en sunn voksen, men andelen øker hos sigdcellepasienter . I tillegg til disse sunne voksenvariantene, er det et dusin andre varianter av humant hemoglobin, som finnes i embryoet , fosteret eller pasienter med en eller flere former for hemoglobinopati .
Embryonale hemoglobiner
Fire typer embryonalt hemoglobin er kjent hos mennesker :
- Hb Gower-1 , med formel ζ 2 ε 2, er relativt ustabil og nedbrytes lett;
- Hb Gower-2 , med formel α 2 ε 2, mer stabil enn Gower-1-varianten, finnes i små mengder i løpet av foster- og fosterlivet; det er blitt foreslått som en behandling ved reaktivering av genet hos pasienter som lider av hemoglobinopatier så som β-thalassemia hos hvem reaktivering av hemoglobin F er kontraindisert av hensyn til toksisitet;
- Hb Portland-1 , med formel ζ 2 γ 2, er tilstede i små mengder i løpet av foster- og fosterlivet;
- Hb Portland-2 , med formel ζ 2 β 2, er enda mer ustabil enn Gower-1-varianten, men har blitt foreslått som en genreaktiveringsbehandling hos pasienter med α-thalassemia .
Embryonalt hemoglobin er noen ganger symbolisert av Hbε, som ikke skal forveksles med hemoglobin E, betegnet HbE, som er en patologisk variant av HbA som presenterer en skadelig mutasjon på β-underenhetene, betegnet β E ("E" i dette tilfellet refererer til rest av glutamat modifisert ved mutasjon ).
Fosterhemmoglobin
Den føtalt hemoglobin HbF med formel α 2 γ 2, erstatter embryonalt hemoglobin etter 10 til 12 ukers utvikling. Det utgjør opptil 95% av det nyfødte blodet , og erstattes gradvis av voksen hemoglobin HbA fra den sjette måneden etter fødselen; det forblir imidlertid til stede i spor hos voksne, der det ikke overstiger 1% av alle påvisbare hemoglobinvarianter. Hun forblir hos barn som er produsert under bestemt thalassemi, spesielt opp til femårsalderen, og en sjelden tilstand som kalles arvelig utholdenhet av fosterhemoglobinlidelse (en) ( HPFH ) resulterer i produksjon av HbF i stedet for HbA utover den normale perioden. I tillegg kan produksjonen av HbF reaktiveres hos voksne i en terapeutisk setting for å behandle sigdcelleanemi .
Føtalt hemoglobin er karakterisert ved en større affinitet til oksygen enn voksen hemoglobin, noe som gjør at fosteret oksygene seg fra sin morens blod: ja, p 50 til HbF er omtrent 19 mmHg ( 2,6 kPa ), sammenlignet med 26,8 mmHg ( 3,6 kPa ) for HbA. Denne forskjellen i affinitet for oksygen skyldes en forskjell i affinitet for en av de allosteriske effektene av hemoglobin: 2,3-bisfosfoglyserat (2,3-BPG), hvis binding med hemoglobin har den effekten at T-formen til dette proteinet stabiliseres, som tilsvarer deoksyhemoglobin, noe som reduserer affiniteten til hemoglobin for oksygen. I tilfelle av føtal hemoglobin har γ-underenheten en rest av serin i posisjon 143, der en underenhet β HbA har en rest av histidin : denne posisjonen er lokalisert på bindingsstedet 2,3-BPG, og erstatning av en histidin, hvis sidekjede bærer en positiv elektrisk ladning , av en elektrisk nøytral serin, svekker interaksjonen mellom 2,3-BPG og hemoglobin, fordi 2, 3-BPG er et lite molekyl som bærer fem negative elektriske ladninger.
Hemoglobinopatier
De thalassemias er karakterisert ved utilstrekkelig produksjon av en av to typer underenheter av hemoglobin voksen. Det skilles således mellom α-thalassemia , som er ganske sjelden, der α-underenhetene er utilstrekkelig produsert, og β-thalassemia , den vanligste, der det er β-underenhetene som er utilstrekkelig produsert. Den første fører til dannelse av β-globintetramerer kalt hemoglobin H , med formel β 4, som er ganske ustabile. De oc 0 homozygoter generelt ikke overleve lenge etter fødselen på grunn av en dyptgripende endring av føtalt hemoglobin HbF, noe som gir under disse betingelser Barts hemoglobin , av formelen γ 4.
De viktigste mutasjonene i hemoglobin er:
- den hemoglobin C , med formelen a 2 β C 2, Som svarer til en E6K substitusjon, erstatning av glutamat resten i stilling 6 ved en lysin- rest . Førstnevnte har en kort, negativt ladet sidekjede , mens sistnevnte har en lang, positivt ladet sidekjede, som påvirker den generelle plastisiteten til erytrocytter . De heterozygoter har en 28% til 44% hemoglobin C, som forblir symptomfri, mens homozygote har 100% hemoglobin C, noe som forårsaker en mild hemolytisk anemi . Hemoglobinet C genet er hovedsakelig til stede i Vest-Afrika , hvor det kan ha en forebyggende fordel mot malaria som andre hemoglobinpatier, samt i Sør-Europa , Latin-Amerika og regionene. Caribbean ;
- den hemoglobin E ' med formelen a 2 β E 2, som tilsvarer en E26K-substitusjon, erstatning av glutamatresten i posisjon 26 med en lysinrest. Denne mutasjonen påvirker rundt 1 million mennesker over hele verden, hovedsakelig i Sørøst-Asia . Det påvirker ekspresjonen av β-globin ved å indusere en alternativ spleising av messenger-RNA ved kodoner 25-27, derav et underskudd i produksjonen av normalt β-globin, noe som fører til β-thalassemia . I tillegg β E -subenheter samvirker mindre sterkt med a-underenheter, som gjør at hemoglobin E molekylene mindre stabil i nærvær av oksidanter ;
- den hemoglobin S , med formelen α 2 β S 2, som tilsvarer en E6V-substitusjon, erstatning av glutamatresten i posisjon 6 med en valinrest . Denne substitusjonen, som plasserer en aminosyrerest hydrofob til overflaten av proteinet, skaper en sone av vedheft som fremmer utfellingen av hemoglobin S i lange filamenter som strekker erytrocyttene og gir dem en sigd ( sigd på engelsk, derav "S" av denne varianten), derav navnet sigdcelleanemi også gitt til denne sykdommen, også kalt sigdcelleanemi . S-genet er hovedsakelig til stede i Afrika sør for Sahara , Midt-Østen og Sentral- India : i 2013 ble det estimert til 3,2 millioner antall homozygoter som lider av sigdcellesykdom, og til 43 millioner antall heterozygoter med sigdcelleanvisning. . Deres anemi beskytter dem mot malaria , derav en selektiv fordel som favoriserer utbredelsen av sigdcellegenet i skadelige regioner.
Analoge molekyler
Det er et bredt utvalg av proteiner i planter og dyr som binder seg til oksygen for lagring eller transport. De bakterier , den protozoer og sopp har alt også til hemoglobin relaterte proteiner som etter sin kjent eller forutsagte funksjon, binder til ligandene gassformige reversibelt. I tillegg til å transportere og oppdage oksygen, kan disse proteinene være involvert i å fjerne oksygen fra medier som antas å forbli anaerobe , slik det også er tilfelle med leghemoglobin .
Siden mange slike proteiner består av globiner og hem , blir de ofte referert til som "hemoglobin" selv om deres generelle struktur er veldig forskjellig fra hemoglobin hos virveldyr . Spesielt er skillet mellom myoglobin og hemoglobin ofte umulig hos de enkleste dyrene i fravær av muskler i sistnevnte, mens sirkulasjonssystemet til de fleste insekter ikke er involvert i diffusjonen av oksygen til gjennom kroppen. En rekke leddyr ( edderkopper , skorpioner , noen krepsdyr ) bruker nøkkelhullet , som er et kobberholdig fritt hem, men bruker kationer av kobber direkte koordinert med rester av histidin , men dette proteinet er ikke homologt med hemoglobin.
Strukturen til hemoglobiner er veldig variabel avhengig av arten som vurderes. Det er ofte monoglobin i bakterier, protozoer, alger og planter , mens mange nematoder , bløtdyr og krepsdyr har veldig store proteiner som inneholder et mye høyere antall underenheter enn hos virveldyr. Sopp og annelider har spesielt kimære hemoglobiner som inneholder både globiner og andre typer proteiner. Dermed blir gigantiske tubeworm av de hydrotermale inneholder en rekke av hemoglobin som omfatter ikke mindre enn 144 globin underenheter, som hver er forbundet med en hem-gruppen, hvis rolle er å fange oksygen O toog hydrogensulfid H 2 Snødvendig for bakterier som lever i symbiose med den, samt karbondioksid CO 2nødvendig for ormens anabolisme . Disse strukturene er bemerkelsesverdige ved at de kan transportere oksygen i nærvær av sulfid -ioner og transportere disse ioner seg uten å bli forgiftet av dem som er hemoglobiner av andre arter.
Blant andre proteiner enn hemoglobin som er i stand til å binde seg til oksygen, kan følgende molekyler beholdes:
- Myoglobin - Funnet i musklene til de fleste virveldyr , inkludert mennesker , gir det disse vevene en rød eller mørk grå fargetone. Dens struktur er veldig lik globin- underenhetene til hemoglobin, men er monomer , og har derfor ingen samarbeidseffekt ved binding til oksygen. Det er mer involvert i lagring av oksygen enn i transporten.
- Hemocyanin - Den nest vanligste oksygenbæreren i naturen etter hemoglobin, finnes i mange leddyr og bløtdyr . Den bruker en prostetisk gruppe som består av kobber, ikke heme jern , og oppviser en blå farge når oksygen.
- Hemerythrin - Noenmarine virvelløse dyr og noen arter av annelider bruker dette ikke-heme jernproteinet til å transportere oksygen. Den har en rosa eller lilla farge når den er oksygenert, og er klar når den ikke er oksygenert.
- Chlorocruorin - Funnet i mange annelider, det er veldig likt erythrocruorin, men hemgruppen har en markant annen struktur. Den er rød når den er oksygenert, og grønn når den er deoksygenert (derav navnet).
- Erythrocruorin - Funnet i mange annelider, inkludert meitemark , er dette et veldig stort protein som kan inneholde over hundre proteinunderenheter og hemeenheter, som alle har en molekylvekt på opptil 3600 kDa .
- Leghemoglobin - Tilstede i pods , slik som alfalfa og soyabønner , har den funksjon å beskytte bakterier feste nitrogen oksygen for å tillate at nitrogenase for å redusere den nitrogenet , som det kan gjøre i nærvær av oksygen.
Klinisk bruk
I medisin refererer flere termer til hemoglobin:
- Hemoglobinnivået uttrykkes i g / 100 ml . Normale hemoglobinverdier avhenger av subjektets kjønn og alder. Et hemoglobinnivå under normen definerer anemi . Referanseverdiene er høyere for menn enn for kvinner. En studie stiller spørsmål ved hemoglobin-referanser, og hevder at det ikke er berettiget å ha forskjellige hemoglobin-referanser for menn og kvinner.
- Den metning SaO 2definert som% beregnes av mengden oxyhemoglobin delt på den totale mengden hemoglobin i blodet. Den metning SaO 2kan måles på venøst blod eller arterielt blod. En av parametrene i en test som kalles blodgass er oksygenmetningen i blodet . Metningsverdien anses å være farlig hvis den er mindre enn 90% for arterielt blod. Normalverdien er omtrent 96-100% for normale atmosfæriske forhold. På denne verdien snakker vi om O 2 kapasitetblod .
- Den cyanose er et klinisk tegn. Dette er den blålige fargen på integriteten. Det ser ut når den reduserte hemoglobinkonsentrasjonen overstiger 5 g / 100 ml kapillærblod. Det kan maskeres av anemi.
Genetiske sykdommer i hemoglobin
Som mange proteiner presenterer hemoglobinkjeder forskjellige mutasjoner som oftest ikke har noen klinisk innvirkning. Mer enn 500 unormale hemoglobiner er identifisert. Visse mutasjoner (Hb Köln, Indianapolis, etc.) forårsaker ustabilitet av utfelling av tetramer i Heinz-kroppen , eller methemoglobinemia (hemoglobin M).
Noen ganger forårsaker denne mutasjonen en unormal affinitet for oksygen, det vil si, i likhet med Hb Hope, en reduksjon i affinitet med høy P50 som gir en godt tolerert anemi og cyanose i hvile, og innsatsen og høyden blir dårlig støttet., Eller, for eksempel Hb Chesapeake, Malmö eller Olympia, en økning i affinitet med redusert P50 og en kompenserende polycytemi som fører til kliniske manifestasjoner fra en viss alder.
Andre kan være ansvarlige for kronisk hemolyse, HbS (ved mutasjon av glutamin til valin som vil føre til polymerisering av Hb), HbC, eller forverres i heterozygot tilstand en annen hemoglobinopati, HbO Arab, HbD Punjab eller Hb Lepore, eller β-thalassemia, HbE.
Til slutt kan den genetiske skaden ikke relateres til den primære strukturen til proteinet, men til en kvantitativ defekt i syntese, eller en unormalt høy vedvaring av føtal hemoglobin HbF.
Syntesefeil, eller molekylær anomali, er beskrevet under navnene:
Historisk
De første studiene av hemoglobin ble tatt til XIX - tallet i Tyskland . Hemoglobin ble oppdaget i 1840 av Hünefeld, og ble krystallisert i 1851 av Otto Funke (en) , og det var Felix Hoppe-Seyler som demonstrerte den reversible fiksering av oksygen på dette proteinet i 1866. Den tetrameriske naturen og molekylvekten til hemoglobin ble etablert av Gilbert Smithson Adair (en) i 1925 ved å måle det osmotiske trykket til hemoglobinløsninger, som også identifiserte basene for den samarbeidseffekten av oksygenbinding til dette proteinet ved allosteria .
Den tredimensjonale strukturen til hemoglobin ble etablert av Max Perutz i 1959 ved røntgenkrystallografi , noe som førte til at han delte 1962 Nobelprisen i kjemi med John Kendrew , som hadde utført lignende arbeid med myoglobin .
Hemoglobin i kunsten
I 2005 skapte kunstneren Julian Voss-Andreae skulpturen Heart of Steel (Hemoglobin) , modellert på ryggraden i proteinet. Skulpturen er laget av glass og Corten-stål . Verkets rustne utseende er forsettlig og fremkaller den grunnleggende kjemiske reaksjonen av oksygenbinding til jernet i hemoglobin.
Montreal-kunstneren Nicolas Baier skapte Luster (Hemoglobin) -skulpturen, en polert rustfritt stålskulptur som viser strukturen til hemoglobinmolekylet. Skulpturen ligger i atriet til forskningssenteret til McGill University Health Center i Montreal. Skulpturens størrelse er omtrent 10 meter x 10 meter.
Merknader og referanser
- (in) G. Fermi, MF Perutz og B. Shaanan , " The crystal structure of human deoxyhaemoglobin at 1.74 A resolution " , Journal of Molecular Biology , vol. 175, n o to 15. mai 1984, s. 159-174 ( PMID 6726807 , DOI 10.1016 / 0022-2836 (84) 90472-8 , les online )
- Verdiene av massen og antall rester som er angitt her, er verdiene til proteinforløperen som skyldes oversettelsen av genet , før post-translasjonelle modifikasjoner , og kan avvike betydelig fra verdiene som tilsvarer verdiene for det funksjonelle proteinet .
- (i) Robert I. Weed, Claude F. Reed og George Berg , " Er hemoglobin strukturår essensiell komponent av humane erytrocytmembraner? ” , Journal of Clinical Investigation , vol. 42,April 1963, s. 581-588 ( PMID 13999462 , PMCID 289318 , DOI 10,1172 / JCI104747 , lese på nettet )
- (in) E. Domínguez de Villota, MT García Carmona, JJ Rubio og S. Andrés Ruiz , " Equality of the in vivo and in vitro oxygen-binding capacity of hemoglobin in patients with alvorlig luftveissykdom " , British Journal of Anesthesia , vol. 53, n o 12Desember 1981, s. 1325-1328 ( PMID 7317251 , PMCID 289318 , DOI 10,1093 / BJA / 53.12.1325 , lese på nettet )
- (in) Connie CW Hsia , " Respiratory Function of Hemoglobin " , The New England Journal of Medicine , vol. 338, n o 4, 22. januar 1998, s. 239-247 ( PMID 9435331 , DOI 10.1056 / NEJM199801223380407 , les online )
- (in) Mr. Biagioli, Mr. Pinto, D. et al. Cesselli. , “ Uventet uttrykk for α- og β-globin i mesencefaliske dopaminerge nevroner og gliaceller ” , Proceedings of the National Academy of Sciences i De forente stater , vol. 106, n o 36, 8. september 2009, s. 15454-15459 ( PMID 19717439 , PMCID 2732704 , DOI 10.1073 / pnas.0813216106 , les online [PDF] )
- (no) Roy E. Weber og Serge N. Vinogradov, “Ikke- virvelløse hemoglobiner: funksjoner og molekylære tilpasninger ” , Physiological Review , vol. 81 n o 2, April 2001, s. 569-628 ( PMID 11274340 , les online )
- (i) Ross C. Hardison , " En kort historie med hemoglobiner: plante, dyr, protist og bakterier " , Proceedings of the National Academy of Sciences i De forente stater , vol. 93, n o 12 11. juni 1996, s. 5675-5679 ( PMID 8650150 , PMCID 39118 , DOI 10,1073 / pnas.93.12.5675 , JSTOR 39604 , bibcode 1996PNAS ... 93.5675H , lese på nettet )
- (in) Mireille Van CP Beekvelt Willy NJM Colier, Ron A. Wevers og Van Engelen Baziel GM , " Performance of near-infrared spectroscopy in local O2 consumption and blood flow measure in skeletal muscle " , Journal of Applied Physiology , vol. 90, n o to Februar 2001, s. 511-519 ( PMID 11160049 )
- (en) RD Shannon , " effektive ioniske radier Reviderte og systematiske studier av interatomiske avstander i halider og kalkogenider " , Acta Crystallographica Seksjon A: Krystallfysikk, Diffraksjon, Teoretisk og generell krystallografi , Vol. 32, n o 05.09, s. 1976 ( DOI 10.1107 / S0567739476001551 , Bibcode 1976AcCrA..32..751S , les online )
- (in) Wray H. Huestis og Michael A. Raftery , " Conformation and cooperativity in hemoglobin " , Biochemistry , vol. 14, n o 9,6. mai 1975, s. 1886-1892 ( PMID 235969 , DOI 10.1021 / bi00680a013 , les online )
- (in) Frank B. Jensen , " De doble rollene til røde blodlegemer i oksygenlevering av vev: oksygenbærere og regulatorer av lokal blodstrøm " , Journal of Experimental Biology , vol. 212, n o Pt 21,november 2009, s. 3387-3393 ( PMID 19837879 , DOI 10.1242 / jeb.023697 , les online )
- (i) D. Nicholas Bateman , " Carbon Monoxide " , Medicine , vol. 31, n o 10 Oktober 2003, s. 41-42 ( DOI 10.1383 / medc.31.10.41.27810 , les online )
- (in) CL og RL Townsend Maynard , " Effekter på helse ved langvarig eksponering for lave konsentrasjoner av karbonmonoksid " , Occupational & Environmental Medicine , Vol. 59, n o 10 Oktober 2002, s. 708-711 ( PMID 12356933 , PMCID 1740215 , DOI 10.1136 / oem.59.10.708 , JSTOR 27731796 , les online )
- (i) John Haldane , " The Action of Carbonic Oxide on Man " , The Journal of Physiology , Vol. 18, n bein 5-6, 16. november 1895, s. 430-462 ( PMID 16992272 , PMCID 1514663 , DOI 10.1113 / jphysiol.1895.sp000578 , les online )
- (in) Mark Goldstein , " Carbon Monoxide Poisoning " , Journal of Emergency Nursing , Vol. 34, n o 6, desember 2006, s. 538-542 ( PMID 19022078 , DOI 10.1016 / j.jen.2007.11.014 , les online )
- (in) Tim Struttmann Amy Scheerer, T. Scott Prince og Linda A. Goldstein , " Utilsiktet karbonmonoksidforgiftning fra en usannsynlig kilde " , Journal of the American Board of Family Medicine , vol. 11, n o 6, November-desember 1998, s. 481-484 ( PMID 9876005 , DOI 10.3122 / jabfm.11.6.481 , les online )
- (i) Edward R. Burka , " Karakteristikker av RNA-nedbrytning i erytroidcellen " , Journal of Clinical Investigation , Vol. 48, n o 7, Juli 1969, s. 1266-1272 ( PMID 5794250 , PMCID 322349 , DOI 10.1172 / JCI106092 , les online )
- (in) Goro Kikuchi, Tadashi Yoshida Masato Noguchi , " Heme oxygenase and heme degradation " , Biochemical and Biophysical Research Communications , Vol. 338, n o 1, 9. desember 2005, s. 558-567 ( PMID 16115609 , DOI 10.1016 / j.bbrc.2005.08.020 , les online )
- (i) Ross C. Hardison , " Evolution of Hemoglobin and Its Genes " , Cold Spring Harbour Perspectives in Medicine , vol. 2, n o 12 Desember 2012, a011627 ( PMID 23209182 , PMCID 3543078 , DOI 10.1101 / cshperspect.a011627 , les online )
- (i) Morris Goodman, William G. Moore og Genji Matsuda , " Darwinian Evolution in the genealogy of hemoglobin " , Nature , vol. 253, n o 5493, 20. februar 1975, s. 603-608 ( PMID 1089897 , DOI 10.1038 / 253603a0 , Bibcode 1975Natur.253..603G , les online )
- (no) Jay F. Storz, Juan C. Opazo og Federico G. Hoffmann , “ Gen duplication, genom duplication, and the functional diversification of vertebrate globins ” , Molecular Phylogenetics and Evolution , vol. 66, n o to Februar 2013, s. 469-478 ( PMID 22846683 , PMCID 4306229 , DOI 10.1016 / j.ympev.2012.07.013 , les online )
- (i) EA Zimmer, SL Martin, Beverley SM, YW Kan og AC Wilson , " Rapid duplication and loss of genes coding for the alpha chain of hemoglobin " , Proceedings of the National Academy of Sciences of the United States , vol. 77, n o 4, April 1980, s. 2158-2162 ( PMID 6929543 , PMCID 348671 , DOI 10.1073 / pnas.77.4.2158 , les online )
- (i) Cynthia M. Beall, Kijoung Song, Robert C. Elston og Melvyn C. Goldstein , " Higher tibetansk avkom overlevelse blant kvinner med høy oksygenmetning genotyper Bosatt på 4000 m " , Proceedings of National Academy of Sciences i USA States of America , vol. 101, n o 39, 28. september 2004, s. 14300–14304 ( PMID 15353580 , PMCID 521103 , DOI 10.1073 / pnas.0405949101 , les online )
- (no) Zhenning He og J. Eric Russell , “ Uttrykk, rensing og karakterisering av humane hemoglobiner Gower-1 (ζ 2 ε 2 ), Gower-2 (α 2 ε 2), og Portland-2 (ζ 2 β 2) samlet i komplekse transgene - knockout-mus ” , Blood , vol. 97, n o 4,15. februar 2001, s. 1099-1105 ( PMID 11159543 , les online )
- (in) J. Eric Russell og Stephen A. Liebhaber , " Reversal of Lethal α- and β-thalassemias in Mice by Expression of Human Embryonic globins " , Blood , Vol. 92, n o 9, November 1998, s. 3057-3063 ( PMID 9787139 , les online )
- (i) Sophie Lanzkron John J. Strouse, Renee Wilson, Mary Catherine Beach, Carlton Haywood Park Haesong Catherine Witkop, Eric B. Bass og Jodi B. Segal , " Systematisk gjennomgang: Hydroxyurea for behandling av voksne med sigdcelleanemi ” , Annals of Internal Medicine , vol. 148, n o 12 17. juni 2008, s. 939-955 ( PMID 18458272 , PMCID 3256736 , DOI 10.7326 / 0003-4819-148-12-200806170-00221 , les online )
- (i) Amos I. Chernoff Virginia Minnich, Supa Na Nakorn, Soodsarkorn Tuchinda, Channivat Kashemsant og Renate R. Chernoff , " Studies on hemoglobin S - I. Den kliniske, hematologisk og genetiske karakteristika for hemoglobin E syndromer " , Journal of Laboratory and Clinical Medicine , vol. 47, n o 3, Mars 1956, s. 455-489 ( PMID 13353880 , les online )
- (in) " Global, regional og nasjonal forekomst, prevalens og år Levd med funksjonshemning for 301 akutte og kroniske sykdommer og skader i 188 land, 1990-2013: en systematisk analyse for Global Burden of Disease Study 2013 " , Lancet , vol. 386, n o 9995, 22. august 2015, s. 743-800 ( PMID 26063472 , DOI 10.1016 / S0140-6736 (15) 60692-4 , les online )
- (i) William E. Royer Jr., Hitesh Sharma, Kristen Strand, James E. Knapp og Balaji Bhyravbhatla , " Lumbricus Erythrocruorin at 3.5 Å Resolution: Architecture of a megadalton Respiratory Complex " , Structure , vol. 14, n o 7, juli 2006, s. 1167-1177 ( PMID 16843898 , DOI 10.1016 / j.str.2006.05.011 , les online )
- (in) Luc Int Panis, Boudewijn Goddeeris og Rudolf Verheyen , " Hemoglobinkonsentrasjonen av Chironomus jfr. Plumosus l. (Diptera: Chironomidae) larver fra to lentiske habitater ” , Netherland Journal of Aquatic Ecology , vol. 29, n o 1, April 1995, s. 1-4 ( DOI 10.1007 / BF02061785 , les online )
- (in) Franck Zal, Francis H. Lallier, Brian N. Green, Serge N. Vinogradov and Andre Toulmond , " Multi-hemoglobin system of the hydrotermale vent tube worm gigant tube orm. II. Komplett polypeptidkjedesammensetning undersøkt ved maksimal entropianalyse av massespektre ” , Journal of Biological Chemistry , vol. 271, n o 15 12. april 1996, s. 8875-8881 ( PMID 8621529 , DOI 10.1074 / jbc.271.15.8875 , les online )
- (in) Zoran Minic og Guy Hervé , " iokjemiske og enzymologiske aspekter av symbiose entre les deep-sea tubeworm giant tube worm and Its bacterial endosymbiont " , The FEBS Journal , vol. 271, n o 15 August 2004, s. 3093-3102 ( PMID 15265029 , DOI 10.1111 / j.1432-1033.2004.04248.x , les online )
- " Hva er beviset for kjønnsforskjeller i ferritin og hemoglobin? » (Besøkt 2. november 2019 )
- Bernard Dreyfus 'hematologi, medisin-vitenskap- Flammarion1992
- (de) Felix Hoppe-Seyler , “ Über die oxidation in lebendem blute ” , Med-chem Untersuch Lab , 1866, s. 133–140
- (i) Gilbert S. Adair , " Det osmotiske trykket av hemoglobin i fravær av salter " , Proceedings of the Royal Society of London. Serie B, Containing Papers of a Biological Character , vol. 98 n o 692, Oktober 1925, s. 524 ( DOI 10.1098 / rspa.1925.0126 , JSTOR 94515 , Bibcode 1925RSPSB..98..524A , les online )
- (en) MF Perutz, Rossmann MG, Ann F. Cullis, Hilary MUIRHEAD, GEORG WILL & ACT NORTH , " Structure of Hemoglobin: A Three-Dimensional Fourier Synthesis at 5.5-Å. Oppløsning, oppnådd ved røntgenanalyse ” , Nature , vol. 185, n o 4711 13. februar 1960, s. 416-422 ( PMID 18990801 , DOI 10.1038 / 185416a0 , les online )
- (en) Max Perutz F. , " Structure of hemoglobin " , Brookhaven Symposia in Biology , vol. 1. 3, 1960, s. 165-183 ( PMID 13734651 )
-
(i) " Nobelprisen i kjemi i 1962 " (åpnet 6. november 2016 ) :
" Nobelprisen i kjemi 1962 ble tildelt i fellesskap til Max Ferdinand Perutz og John Cowdery Kendrew" for sine studier av strukturer av kuleproteiner . "
- (i) Constance Holden , " Blood and Steel " , Science , vol. 309, n o 5744,30. september 2005, s. 2160 ( DOI 10.1126 / science.309.5744.2160d , les online [PDF] )
- (in) Moran L Horton RA Scrimgeour G, Perry M, Principles of Biochemistry , Boston, MA, Pearson ,2011, 786 s. ( ISBN 978-0-321-70733-8 og 0-321-70733-8 ) , s. 127
- (i) Sean Henry, " Ta en titt på MUHCs kunstsamling " på CBC News ,7. august 2014(tilgjengelig på en st februar 2016 )
- " Luster (Hemoglobin) 2014 " på Public Art Montreal (tilgjengelig på en st februar 2016 )
- " Nicolas Baier " på McGill University Health Center (tilgjengelig på en st februar 2016 )
Se også
Bibliografi
- Banerjee, R., & Sagaert, L. (1967). Dissosiasjon av humant hemoglobin i et surt medium . Biochimica and Biophysica Acta (BBA) -Protein Structure, 140 (2), 266-273 ( abstract ).
- Blum, N., Maleknia, M., & Schapira, G. (1970). Gratis α- og β-globiner og hemoglobinbiosyntese. Biochimica et Biophysica Acta (BBA) -Nukleinsyrer og proteinsyntese, 199 (1), 236-247.
- Breton-Gorius, J. (1970). Bruk av diaminobenzidin til demonstrasjon under et elektronmikroskop av intracellulært hemoglobin . Ny Rev. Fr. Hematology, 10, 243-256.
- Caffin, JP, Chauvet, JP, & Acher, R. (1969). Amfibiehemoglobiner: Separasjon og foreløpig karakterisering av hemoglobinkjedene til padden Bufo bufo . FEBS bokstaver, 5 (3), 196-198 ( abstrakt ).
- Bardakdjian-Michau, J., Dhondt, JL, Ducrocq, R., Galactéros, F., Guyard, A., Huchet, FX, ... & Wajcman, H. (2003, juli). God praksis i studiet av hemoglobin . I Annals of Clinical Biology (Vol. 61, nr. 4, s. 401-409).
- Bernard, M., Bordas-Fonfrède, M., Grimaldi, A., Guillemin, C., Stahl, A., Leutenegger, M., & Gillery, P. (1995). Respektive interesser av glykaterte hemoglobin- og fruktosaminanalyser i overvåking av diabetes mellitus . I Annals of clinical biology (Vol. 53, nr. 6, s. 321-327). John Libbey Eurotext.
- Bert, P. (1882). På hemoglobinrikdommen til blod fra dyr som bor høyt. CR Acad Sci Paris, 94, 805-807.
- Bloch-Raphaël, C. (1939). Plassering, dannelse og ødeleggelse av hemoglobin i polychaete annelids (doktoravhandling).
- Eaton, WA og Hofrichter, J. (1990). Seglcellehemoglobinpolymerisering . Fremskritt innen proteinkjemi, 40, 263-279.
- Foettinger, A. (1880). Om eksistensen av hemoglobin i pigghuder . Arch. Biol. Paris, 1, 405-415.
- Kruh, J., Dreyfus, JC, & Schapira, G. (1964). Aktivering av cellefri syntese av hemoglobin med ribonukleinsyre: III. Virkning av total ribonukleinsyre i leveren . Biochimica et Biophysica Acta (BBA) -Spesialisert seksjon om nukleinsyrer og relaterte emner, 91 (3), 494-505 ( abstrakt ).
- Kruh, J., Dreyfus, JC, Rosa, J., & Schapira, G. (1962). Syntese av hemoglobin av cellefrie retikulocytt-systemer . Biochimica et Biophysica Acta (BBA) - Spesialisert seksjon om nukleinsyrer og relaterte emner, 55 (5), 690-703.
- Lambert, PP, Grégoire, F., & Royers, E. (1955). Glomerulær hemodynamikk og hemoglobinutskillelse . Archives Of Physiology And Biochemistry, 63 (1), 7-34 ( abstract ).
- Lena-Russo, D., North, ML, & Girot, R. (1992). Epidemiologi av genetiske hemoglobinsykdommer i Frankrike . The Practitioner Review, 42 (15), 1867-1872.
- Robert, M. (1975). Affinitet av hemoglobin for oksygen . Kantonal sykehus, medisinsk avdeling, terapeutisk medisinsk klinikk.
- Uriel, J. (1958). Påvisning av katalase- og peroksidaseaktiviteter av hemoglobin etter agarelektroforese . Bulletin of the Society of Biological Chemistry, 40, 277-280.
- White, CT, Murray, AJ, Smith, DJ, Greene, JR, & Bolin, RB (1986). Synergistisk toksisitet av endotoksin og hemoglobin. J Lab Clin Med, 108 (2), 132-137.