Kofaktor F 430
| Kofaktor F 430 | |
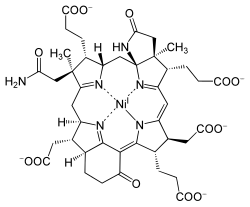 Struktur av F 430- kofaktoren |
|
| Identifikasjon | |
|---|---|
| N o CAS | |
| PubChem | 5460020 |
| ChEBI | 28265 |
| SMIL |
C [C @ @] 12CC (= O) N [C @ @] 13C [C @ H] 4 [C @ H] ([C @] (C (= N4) C [C @ H] 5 [C @H] ([C @@ H] 6CCC (= O) / C (= C / 7 \ [C @ H] ([C @ H) (/ C (= C / C (= N3) [C @ H] 2CCC (= O) O) / [N-] 7) CC (= O) O) CCC (= O) O) / C6 = N5) CC (= O) O) (C) CC (= O) N) CCC (= O) O. [Ni + 2] , |
| InChI |
Std. InChI: InChI = 1S / C42H52N6O13.Ni / c1-40 (16-30 (43) 50) 22 (5-9-33 (54) 55) 27-15-42-41 (2,17-31 ( 51) 48-42) 23 (6-10-34 (56) 57) 26 (47-42) 13-24-20 (11-35 (58) 59) 19 (4-8-32 (52) 53) 39 (45-24) 37-28 (49) 7-3-18-21 (12-36 (60) 61) 25 (46-38 (18) 37) 14-29 (40) 44-27; / h13 , 18-23,25,27H, 3-12,14-17H2,1-2H3, (H9,43,45,46,47,48,49,50,51,52,53,54,55,56, 57,58,59,60,61); / q; + 2 / p-1 / t18-, 19-, 20-, 21-, 22 +, 23 +, 25 +, 27-, 40-, 41- , 42 -; / m0./s1 Std. InChIKey: XLFIRMYGVLUNOY-SXMZNAGASA-M |
| Kjemiske egenskaper | |
| Brute formel |
C 42 H 51 N 6 Ni O 13 [Isomerer] |
| Molarmasse | 906,5801 ± 0,0427 g / mol C 55,64%, H 5,67%, N 9,27%, Ni 6,47%, O 22,94%, |
| Enheter av SI og STP med mindre annet er oppgitt. | |
Den F 430 kofaktorer den protesegruppe av metyl-koenzym M-reduktase , et enzym involvert i den siste fasen av metanogenese i metanogen archaea for å frigjøre metan :
CoB - SH + CoM - S - CH 3→ CoB - S - S - CoM + CH 4.Denne kofaktoren skylder navnet sitt maksimale absorpsjon ved λ max= 430 nm .
Struktur
F 430- kofaktorenisolert er termisk ustabilt og utsatt for oksidasjon. Dens struktur ble bestemt ved røntgenkrystallografi og NMR-spektroskopi . Den har bare fem dobbeltbindinger , noe som gjør den til den minste naturlige tetrapyrrol .
Den aktive formen til F 430inneholder Ni (I) kation , på samme måte som kofaktor B 12 som inneholder Co (I) kation . Disse to ionene har likevel en annen elektronisk konfigurasjon : Co (I) er diamagnetisk med en d 8- konfigurasjon mens Ni (I) er paramagnetisk med en d 9- konfigurasjon . F 430 er den eneste kjente biologiske tetrapyrrolen som fungerer med nikkel.
Det er en variant av F 430tiometylert på karbon 17 2 , som ikke ser ut til å endre reaksjonsegenskapene til Ni (I) kation .
Foreslått mekanisme
Spaltningsmekanismen til CH 3 –S- bindingeni metyl-koenzym M er ikke fullstendig forstått, selv om det er fastslått at koenzym M og koenzym B setter inn på metyl-koenzym M-reduktase i en kanal avsluttet av kofaktor F 430, på et aksialt sted av nikkel. Det er mulig at Ni (I), overfører et elektron til metyl -CH 3for å danne metan CH 4forlater nikkel i Ni (II) oksidasjonstilstand ; sistnevnte reduseres deretter igjen til Ni (I) -tilstanden på tidspunktet for spaltingen av CH 3 –S- bindingenav metyl-koenzym M av koenzym B .
Merknader og referanser
- beregnede molekylmasse fra " atomvekter av elementene 2007 " på www.chem.qmul.ac.uk .
- (en) G. Farber, W. Keller, C. Kratky, B. Jaun, A. Pfaltz, C. Spinner, A. Kobelt, A. Eschenmoser, " Coenzyme F 430 fra metanogene bakterier: Komplett tildeling av konfigurasjon basert på en røntgenanalyse av 12,13-diepi-F430 pentametylester og på NMR-spektroskopi ”, i Helvetica Chimica Acta 1991, 74 , 697-716.
- (in) S. Mayr et al. , " Struktur av en F 430 variant fra archaea assosiert med anaerob oksidasjon av metan ”, i J. Am. Chem. Soc. 2008, 130 (32), 10758–10767. DOI : 10.1021 / ja802929z
- (en) C. Finazzo, J. Harmer, C. Bauer, B. Jaun, EC Duin, F. Mahlert, M. Goenrich, RK Thauer, S. A. Van Doorslaer og Schweiger, " Coenzyme B Induced Coordination of Coenzyme M via sin Thiol-gruppe til Ni (I) av F 430 i Active Methyl-Coenzyme M Reductase ”, i Journal of the American Chemical Society , 2003, 125 , 4988-4989.