Metansyre
| metansyre | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lewis og 3D-formler for metansyre | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikasjon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC-navn | Metansyre | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonymer |
maursyre |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100 000 527 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 200-579-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o E | E236 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 2487 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMIL |
C (= O) O , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / CH2O2 / c2-1-3 / h1H, (H, 2,3) / f / h2H |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Utseende | fargeløs væske, røykfylt, skarp lukt | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kjemiske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formel |
C H 2 O 2 [isomerer] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molarmasse | 46,0254 ± 0,0015 g / mol C 26,1%, H 4,38%, O 69,52%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | 3,751 ( 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dipolar øyeblikk | 1,425 ± 0,002 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molekylær diameter | 0,381 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysiske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fusjon | 8,3 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° kokende | 101 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Løselighet |
1000 g · l -1 (vann, 25 ° C ), |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Løselighetsparameter δ |
24,8 MPa 1/2 ( 25 ° C ); 21,4 J 1/2 · cm -3/2 ( 25 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
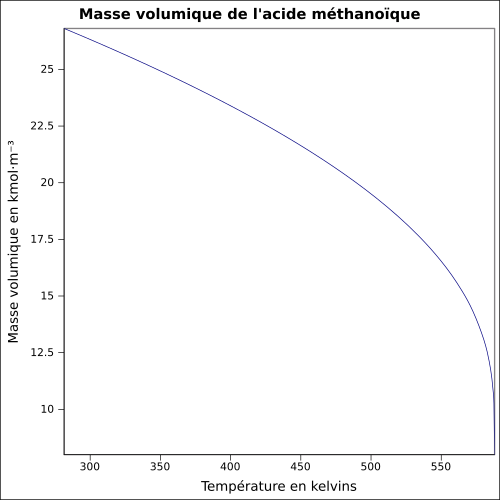
| Volumisk masse | 1,22 ved 25 ° C
ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Selvantennelsestemperatur | 520 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Flammepunkt | 69 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eksplosjonsgrenser i luft | 14 - 34 % vol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mettende damptrykk |
42,6 mmHg ( 25 ° C )
ligning:

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dynamisk viskositet | 1,57 × 10 −3 Pa s ved 26 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritisk punkt | 306,85 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trippel punkt | 281,45 K ( 8,3 ° C ) 23,6 mbar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termokjemi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 gass, 1 bar | 248,7 J mol −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 væske, 1 bar | 131,8 J mol −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 gass | −378,6 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 væske | −425,1 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C s |
45,7 J · mol -1 · K -1 (damp) 99,0 J · mol -1 · K -1 (væske) ligning:
ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCS | 254,6 kJ · mol -1 ( 25 ° C , væske) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroniske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re ioniseringsenergi | 11,33 ± 0,01 eV (gass) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Optiske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brytningsindeks | 1.3694 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forholdsregler | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Fare H226, H302, H314, H331, H226 : Brannfarlig væske og damp H302 : Farlig ved svelging H314 : Gir alvorlige etseskader på huden og øyeskader H331 : Giftig ved innånding |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B3, E, B3 : Brennbart flytende flammepunkt = 46,5 ° C lukket kopp (metode ikke rapportert) E : Etsende materiale Transport av farlig gods: klasse 8 Offentliggjøring ved 1,0% i henhold til listen over ingredienser |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 3 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transportere | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1779 : FORMISYRE |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Innånding | Konsentrerte damper er etsende | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Svelging | Giftig, kan forårsake allergiske reaksjoner. Mistenkt mutagent middel | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Økotoksikologi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL 50 |
700 mg · kg -1 (mus, oral ) 145 mg · kg -1 (mus, iv ) 940 mg · kg -1 (mus, ip ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | -0,54 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Luktterskel | lav: 1,6 spm høy: 340 spm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Enheter av SI og STP med mindre annet er oppgitt. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Den metansyre (også kjent som maursyre ) er de enkleste karboksylsyrer . Den kjemiske formel er C H 2 O 2 eller HCOOH. Dens korresponderende base er den methanoate ion (formiat) med formelen HCOO - . Det er en svak syre som kommer i form av en fargeløs væske med en gjennomtrengende lukt.
I naturen finnes den i kjertlene til flere insekter av ordenen Hymenoptera , som bier og maur , men også på hårene som utgjør bladene til visse planter av urticaceae- familien ( nesle ). Dets trivielle formiske navn kommer fra det latinske ordet formica som betyr maur, fordi det ble isolert for første gang ved destillasjon av maur.
Historie
Fra det XV th -tallet, noe alkymister og natur var klar over at noen maur , særlig den type Formica , som produserer en damp syre . Den første personen som har beskrevet isolasjonen av dette stoffet (ved destillasjon av et stort antall lik av maur) er den engelske naturforskeren John Ray i 1671. Hans første syntese ble laget av den franske kjemikeren Gay-Lussac fra l ' hydrocyansyre . I 1855 utviklet en annen fransk kjemiker, Marcellin Berthelot , en metode for syntese fra karbonmonoksid , lik den som brukes i dag. Myresyre er tilstede i sammensetningen av flertallet av myregifter , som sprayer eller påfører den direkte for å gjennombore neglebåndet til andre leddyr eller avvise mulige rovdyr .
Kjemi
Reduserende egenskaper
Oppvarmet med svovelsyre , nedbrytes maursyre til vann og karbonmonoksid , slik at den har meget markante reduserende egenskaper (reduksjon av gull , sølv , kobbersalter , etc.). Under påvirkning av varme alene nedbrytes den ved rundt 160 ° C til hydrogen og karbondioksid , noe som igjen resulterer i reduserende egenskaper.
Svak syre
Selv om det er mer ionisert enn dets kolleger med høyere karboksylsyre, er det en svak syre , men til tross for dette er den i stand til å fortrenge salpetersyre fra saltene. Hvis maursyre tilsettes til en blanding av kaliumnitrat og brucin , blir blandingen øyeblikkelig rød. Det gir ikke noen syreanhydrid og gir som acylhalogenid tilsvarende den fosgen COCI 2 .
Produksjon
Ved oppvarming av kalium og karbonmonoksid i et forseglet rør , syntetiserte Berthelot maursyre: CO + KOH → H-CO 2 K, deretter under et trykk på 7 atm. og ved 170 ° C , hydrolyse av kaliumformat 2 K med svovelsyre ; produktet oppnådd ved destillasjon under redusert trykk inneholder 80 til 85% maursyre.
Bruker
Metansyre brukes i følgende bransjer: tekstiler ( fargestoffer , lærbehandling ), insektmidler , lakk , løsningsmidler , garvning , galvanisering, fumiganter , menneskelig mat ( tilsetningsstoff E236). Det brukes også til sølvspeil og til å behandle vorter.
Det brukes også i biavl som et komplementært middel for å kontrollere varroa . Den brukes også i avkalkingsmidler (toalettgel).
Biologisk sporstoff
Under metanolforgiftning metaboliseres sistnevnte først til metanal ved virkningen av alkoholdehydrogenase , et uspesifikt enzym som har bedre affinitet med etanol , deretter til maursyre via virkningen av formaldehyddehydrogenase . Den siste fasen består av transformasjonen til karbondioksid , et trinn som begrenser eliminasjonen. Ettersom metanal raskt transformeres, dannes en akkumulering av formiat og er årsaken til toksisitet ( metabolsk acidose ). Måling av formater i urin kan påvise metanolforgiftning.
Forskning fra Leibniz Institute for Catalysis i Rostock har vist at den kan brukes til lagring av hydrogen for å drive en brenselcelle .
I nærvær av platina er det mulig å nedbryte maursyre i hydrogen og karbondioksid .
CH 2 O 2 → H 2 + CO 2I 2006 presenterte et forskerteam fra EPFL (Sveits) bruken av maursyre som en hydrogenlagringsløsning . En homogen katalytisk system, basert på en vandig løsning av ruthenium-katalysatorer spaltes maursyre, HCOOH inn i dihydrogen H 2 og karbondioksyd CO 2 . Dihydrogen kan således produseres over et bredt trykkområde ( 1-600 bar ), og reaksjonen genererer ikke karbonmonoksid . Dette katalytiske systemet løser problemene med eksisterende katalysatorer for spaltning av maursyre (lav stabilitet, begrenset katalysatorlevetid, dannelse av karbonmonoksid) og gjør denne metoden for lagring av hydrogen levedyktig. Samproduktet av denne nedbrytningen, karbondioksid, kan brukes i et andre trinn for å generere maursyre igjen ved hydrogenering. Den katalytiske hydrogeneringen av CO 2 har blitt studert grundig og effektive metoder er utviklet.
Myresyre inneholder 53 g · l -1 hydrogen ved romtemperatur og trykk, som er dobbelt så stor som kapasiteten til hydrogen komprimert ved 350 bar . Ren maursyre er en brennbar væske med et flammepunkt på + 69 ° C , som er høyere enn bensin ( −40 ° C ) eller etanol (+ 13 ° C ). Fortynnet fra 85%, det er ikke lenger brannfarlig. Fortynnet maursyre er til og med på Food and Drug Administration (FDA) liste over tilsetningsstoffer.
Handel
Frankrike er nettoimportør av maursyre, ifølge fransk toll. Gjennomsnittsprisen per tonn importert var € 600.
Oppdagelse utenfor solsystemet
I 2018 ble metansyre oppdaget av ALMA - radioteleskopet i protoplanetarskiven til stjernen TW Hydrae .
Merknader og referanser
- FORMIC ACID, sikkerhetsdatablad (er) for det internasjonale programmet for sikkerhet for kjemiske stoffer , konsultert 9. mai 2009
- (en) " Metansyre " , på ChemIDplus , åpnet 8. februar 2009
- (in) David R. Lide, håndbok for kjemi og fysikk , CRC,16. juni 2008, 89 th ed. , 2736 s. ( ISBN 142006679X og 978-1420066791 ) , s. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents , vol. 4, England, John Wiley & Sons Ltd,1999, 239 s. ( ISBN 0-471-98369-1 )
- beregnede molekylmasse fra " atomvekter av elementene 2007 " på www.chem.qmul.ac.uk .
- (in) James E. Mark, Physical Properties of Polymer Handbook , Springer,2007, 2 nd ed. , 1076 s. ( ISBN 0387690026 , leses online ) , s. 294
- (no) Robert H. Perry og Donald W. Green , Perrys Chemical Engineers 'Handbook , USA, McGraw-Hill,1997, 7 th ed. , 2400 s. ( ISBN 0-07-049841-5 ) , s. 2-50
- " Properties of Various Gases ", på flexwareinc.com (åpnet 12. april 2010 )
- (i) Carl L. yaws, Handbook of Thermodynamic diagrammer , vol. 1, 2 og 3, Huston, Texas, Gulf Pub. Co.,1996( ISBN 0-88415-857-8 , 978-0-88415-858-5 og 978-0-88415-859-2 )
- (in) David R. Lide , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press,18. juni 2002, 83 th ed. , 2664 s. ( ISBN 0849304830 , online presentasjon ) , s. 5-89
- (in) David R. Lide, håndbok for kjemi og fysikk , CRC,2008, 89 th ed. , 2736 s. ( ISBN 978-1-4200-6679-1 ) , s. 10-205
- Sikkerhetsdatablad publisert av Sigma-Aldrich, konsultert 5. september 2020
- " Myresyre " i databasen over kjemiske produkter Reptox fra CSST (Quebec-organisasjonen med ansvar for arbeidsmiljø og helse), åpnet 24. april 2009
- " Maursyre, " ved hazmap.nlm.nih.gov (vist 14.11.2009 )
- http://www.myrmecofourmis.fr/Jets-d-acide-formique-par-des-fourmis
- " Se giften til disse maurene blåse bobler!" » [Video] , på YouTube (åpnet 12. september 2020 ) .
- Codex Alimentarius, “ Grade Names and International Numbering System for Food Additives ” , på http://www.codexalimentarius.net ,2009(åpnet 19. mai 2010 )
- Beekeeper68, " Behandling av Varroa med maursyre " , på http://same-apiculture.colinweb.fr/ ,18. desember 2010(åpnet 17. august 2017 )
- http://www.bulletins-electroniques.com/actualites/54627.htm
- Gábor Laurenczy, Céline Fellay, Paul J. Dyson, Hydrogenproduksjon fra maursyre. PCT Int. Appl. (2008), 36 sider. KODE: PIXXD2 WO 2008047312 A1 20080424 AN 2008: 502691
- Céline Fellay, Paul J. Dyson, Gábor Laurenczy, et levedyktig hydrogenlagringssystem basert på selektiv nedbrytning av maursyre med en Ruthenium-katalysator, Angew. Chem. Int. Red. , 2008 , 47 , 3966–3970.
- Ferenc Joó, gjennombrudd i hydrogenlagring - myresyre som et bærekraftig lagringsmateriale for hydrogen, ChemSusChem 2008 , 1 , 805–808.
- PG Jessop, i Handbook of Homogeneous Hydrogenation (Red.: JG de Vries, CJ Elsevier), Wiley-VCH, Weinheim, Tyskland, 2007 , s. 489–511 .
- PG Jessop, F. Joó, C.-C. Tai, Nylige fremskritt innen homogen hydrogenering av karbondioksid, Coord. Chem. Rev. , 2004 , 248, 2425–2442.
- US Code of Federal Regulations: 21 CFR 186.1316, 21 CFR 172.515
- " Indikator for import / eksporthandel " , på Tolldirektoratet. Angi NC8 = 29151100 (åpnet 7. august 2015 )
- (en) Cécile Favre, Davide Fedele, Dmitry Semenov, Sergey Parfenov et al. , “ Første påvisning av den enkleste organiske syren i en protoplanetar disk ” , The Astrophysical Journal Letters ,16. juli 2018( les online ).