Aluminiumklorid
| aluminium (III) klorid | |||||
  
|
|||||
| Identifikasjon | |||||
|---|---|---|---|---|---|
| IUPAC-navn | trikloraluman | ||||
| Synonymer |
aluminiumtriklorid |
||||
| N o CAS | |||||
| N o ECHA | 100.028.371 | ||||
| N o EC | 231-208-1 | ||||
| N o RTECS | BD0525000 | ||||
| ATC-kode | D10 | ||||
| PubChem | 24012 | ||||
| InChI |
InChIKey: VSCWAEJMTAWNJL-UHFFFAOYSA-K |
||||
| Utseende | lysegult fast stoff | ||||
| Kjemiske egenskaper | |||||
| Brute formel |
Al Cl 3 [Isomerer] |
||||
| Molarmasse | 133,341 ± 0,006 g / mol Al 20,23%, Cl 79,76%, |
||||
| Fysiske egenskaper | |||||
| T ° fusjon | 463 K ( 190 ° C ) ved et trykk på 2,5 atm |
||||
| T ° kokende | 182,7 ° C ved 752 mmHg (sublimering) | ||||
| Løselighet | i vannet : 439 g · l -1 ( 0 ° C ), 449 g · l -1 ( 10 ° C ), 458 g · l -1 ( 20 ° C ) 466 g · l -1 ( 30 ° C ) 473 g - l- 1 ( 40 ° C ) 481 g - l -1 ( 60 ° C ) 486 g - l -1 ( 80 ° C ) 490 g - l -1 ( 100 ° C ). ethanol : 1,000 g · l -1 ( 12,5 ° C ). kloroform : 0,7 g · l -1 ( 20 ° C ). CCl 4 : løselig. eter : løselig |
||||
| Volumisk masse | 2,44 for å 2,48 g / cm 3 | ||||
| Kritisk punkt | 26,3 bar , 346,85 ° C | ||||
| Krystallografi | |||||
| Krystallsystem | Monoklinikk | ||||
| Bravais nettverk | mC | ||||
| Pearson symbol | |||||
| Krystallklasse eller romgruppe | C2 / m ( n o 12) | ||||
| Strukturbericht | D0 15 | ||||
| Forholdsregler | |||||
| SGH | |||||
 Fare H314, H314 : Gir alvorlige etseskader på huden og øyeskader |
|||||
| NFPA 704 | |||||
| 0 3 2 W | |||||
| Transportere | |||||
80 : etsende stoff eller en som viser en liten grad av etsende FN-nummer : 1726 : ANHYDROUS ALUMINIUMKLORID Klasse: 8 Klassifiseringskode: C2 : Etsende stoffer uten subsidiær risiko; Sure stoffer: Uorganisk, fast; Etikett: 8 : etsende stoffer Emballasje: Emballasje gruppe II : mellom farlige stoffer; 
80 : etsende stoff eller stoff som viser en liten grad av korrosivitet UN-nummer : 2581 : ALUMINIUMKLORIDLØSNING Klasse: 8 Klassifiseringskode: C1 : Etsende stoffer uten subsidiær risiko; Sure stoffer: Uorganisk, flytende; Etikett: 8 : etsende stoffer Emballasje: Emballasje gruppe III : substanser med liten fare.  |
|||||
| Økotoksikologi | |||||
| DL 50 | 3450 mg · kg -1 | ||||
| Enheter av SI og STP med mindre annet er oppgitt. | |||||
Den aluminiumklorid (AlCl 3 ), også kjent som aluminiumtriklorid eller aluminiumklorid (III) er et salt av aluminium og klor . Den vannfrie formen har en spesiell struktur: selv om det er et halogenid av et veldig elektropositivt metall , er de kjemiske bindingene hovedsakelig kovalente og ikke ioniske som man forventer. En konsekvens av dette er at AlCl 3 har lavt smelte og sublimeringstemperatur ( 178 ° C for den sistnevnte), og at det i den flytende tilstand , det leder elektrisitet dårlig, i motsetning til ionisk halogenider slik som klorid. Natrium . Denne forbindelsen eksisterer i fast tilstand i form av et heksakoordinatnettverk. Det smelter for å danne en dimer tetracoordinated, Al 2 Cl 6, som kan fordampe , men som dissosierer ved høyere temperatur for å danne en AlCl 3 art som ligner på BF 3 .
Aluminiumklorid er veldig lekker og kan eksplodere ved kontakt med vann under påvirkning av hydrering . Den hydrolyserer delvis i nærvær av vann for å danne hydrogenklorid ( saltsyre ). I vandig oppløsning , AlCl 3 er fullstendig ionisert , og oppløsningen leder elektrisk strøm brønn . Denne løsningen er sur . På en forenklet måte er kationen produsert ved reaksjon av aluminiumklorid med vann skrevet:
AlCl 3 er trolig den mest brukte og kraftig Lewis syre . Denne forbindelsen har mange anvendelser i den kjemiske industrien , spesielt som en katalysator for Friedel og Crafts-reaksjoner , både alkylering og acylering . Det brukes også til reaksjoner av polymerisering eller isomerisering av organiske forbindelser .
Det finnes også et aluminium (I) klorid (AlCl), men det er veldig ustabilt og er bare kjent i gassform .
Fysisk-kjemiske egenskaper
I fast tilstand krystalliserer aluminiumklorid i henhold til YCl 3- struktur , med Al 3+ -ionene som danner et ansiktssentrert kubisk nettverk.
Aluminiumklorid er en kraftig Lewis-syre som er i stand til å reagere i henhold til Lewis-syre-basereaksjoner med til og med svake Lewis-baser som benzofenon eller mesitylene . I nærvær av et klorid -ion , det reagerer for å danne AlCl 4 - .
Den hydrolysen delvis i nærvær av vann som hydrogenklorid og / eller av saltsyre . Vandige oppløsninger av aluminiumklorid oppfører seg på samme måte som oppløsninger av andre salter som inneholder hydratiserte Al 3+ -ioner. For eksempel, plassert i nærvær av passende mengde brus , danner det et gelatinøst bunnfall av aluminiumhydroksid :
AlCl 3 (aq) + 3 NaOH (aq) → Al (OH) 3 (s) + 3 NaCl (aq)
Krystallstruktur
I fast tilstand, aluminiumklorid krystalliserer i en monoklin struktur , slik som RhCl 3 , av romgruppe C 2 / m. Dens mesh parametre er a = 5,914 Å , b = 10,234 Å og c = 6,148 Å med β = 108.25 ° . I masken inntar aluminium Wyckoff-posisjonen 4g (y = 0,166) og klor posisjonene 4i (x = 0,215 og z = 0,226) og 8j (x = 0,252, y = 0,321, z = 0,225). Den oppnådde strukturen er en struktur i ark i planet (a, c), hvor aluminium blir plassert i midten av oktaeder av aluminium, og i bikake i planet (a, b).
Forberedelse
Aluminiumklorid produseres industrielt ved direkte reaksjon av elementene aluminium og klor :
2 Al + 3 Cl 2 → 2 AlCl 3Eller fra aluminium og saltsyre :
2 Al + 6 HCl → 2 AlCl 3 + 3 H 2Denne reaksjonen er eksoterm.
Bruker
- Hovedbruken av aluminiumklorid vedrører fremstilling av forbindelser ved Friedel and Crafts-reaksjonen som det er en katalysator for , for eksempel fremstilling av antrakinon (for fargestoffindustrien ) fra benzen og fosgen . Under Friedel and Crafts-reaksjonen reagerer et acylklorid eller et alkylhalogenid med følgende aromatiske forbindelse :
Med benzenderivater er det viktigste reaksjonsproduktet para- isomeren . Siden alkyleringsreaksjonen utgjør mange problemer, er den mindre brukt enn acyleringsreaksjonen. I begge tilfeller må aluminiumkloridet (eller det anvendte apparatet) ikke være helt vannfritt, spor av fuktighet er nødvendig for gjennomføringen av reaksjonen. Et av problemene med Friedel and Crafts-reaksjonen er at katalysatoren (aluminiumklorid) må være tilstede i en støkiometrisk mengde for at reaksjonen skal bli fullstendig fordi den danner et stabilt kompleks med produktet. Denne særegenheten gjør det veldig vanskelig å resirkulere , slik at de må ødelegges etter bruk, noe som genererer en stor mengde korroderende avløp. Av denne grunn undersøker kjemikere muligheten for å bruke mer miljønøytrale katalysatorer som ytterbiumtrifluormetansulfonat (III) eller dysprosiumtrifluormetansulfonat (III) som er dyrere men kan resirkuleres.
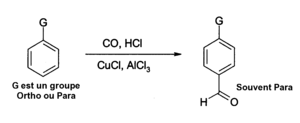
- Aluminiumkloridet kan også brukes i funksjonene til innføringsreaksjoner av aldehyder under ringaromatisk , for eksempel etter en Gatterman-Koch-reaksjon som bruker karbonmonoksid , hydrogenklorid og kobberklorid (I) som en katalysator:
- Aluminiumklorid har mange andre bruksområder innen organisk kjemi :
- AlCl 3 anvendes i reaksjoner for polymerisering eller isomerisering av organiske forbindelser . Viktige bruksområder er produksjon av etylbenzen (brukes til å lage styren og deretter polystyren ), og produksjon av dodecylbenzen (brukes til å lage vaskemidler );
- AlCl 3 katalyserer i særdeleshet den Diels-Alder-reaksjon ;
- AlCl 3 katalyserer også tilsetningen av 3-buten-2-on til carvon :
- Til slutt er det et uorganisk koaguleringsmiddel som er mye brukt av visse vannrensingsprosesser , i form av polyaluminiumklorid (PAC). I denne sammenheng kan det også fjerne overflødig fluor fra vannet. For å unngå å forurense drikkevann med aluminium og for god koagulering, må koagulasjonsprosessens pH være godt kontrollert, samt dosene som brukes. Omrøringen av vannet må være tilstrekkelig, så vel som filtreringssystemet (som må fjerne aluminiumsagglomeratene). Den kitosan og bentonitt er nyttige additiver.
sikkerhet
AlCl 3 kan forårsake en eksplosjon ved kontakt med base eller vann . Det er et reagens som skal håndteres med forsiktighet ved å bruke hansker og vernebriller. Den skal håndteres under avtrekksvifte. Når den håndteres i fuktig luft, absorberer aluminiumklorid fuktighet raskt for å bli svært sur , og det angriper raskt en rekke materialer, inkludert rustfritt stål og gummi .
Aluminiumkloridheksahydrat
Kjemisk formel: AlCl 3 (H 2 O) 6
Dette stabile produktet er ikke aggressivt for huden; det inngår til og med i sammensetningen av hudtemaer i dermatologi (se hyperhidrose ).
Hovedsynonymer:
- Fransk navn = aluminiumtrikloridheksahydrat,
- Engelsk navn = Aluminiumtrikloridheksahydrat.
Se også
- Poly aluminiumklorid
Referanser
- NN Greenwood, A. Earnshaw, Chemistry of the Elements , Pergamon Press, Oxford, Storbritannia, 1984.
- Handbook of Chemistry and Physics , 71. utgave, CRC Press, Ann Arbor, Michigan, 1990.
- GA Olah (red.), Friedel-Crafts and Related Reactions , Vol. 1, Interscience, New York, 1963.
- LG Wade, Organic Chemistry , 5. utgave, Prentice Hall, Upper Saddle River, New Jersey, USA, 2003.
- P. Galatsis, i: Handbook of Reagents for Organic Synthesis: Acidic and Basic Reagents , (HJ Reich, JH Rigby, red.), P. 12-15 , Wiley, New York, 1999.
- BB Snider, Accounts of Chemical Research 13 , 426 (1980).
- beregnede molekylmasse fra " atomvekter av elementene 2007 " på www.chem.qmul.ac.uk .
- PubChem
- " Properties of Various Gases ", på flexwareinc.com (åpnet 12. april 2010 )
- " The AlCl3 (D015) Structure " , på http://cst-www.nrl.navy.mil/ (åpnet 17. desember 2009 )
- Indeksnummer i tabell 3.1 i vedlegg VI til EF-forordning nr . 1272/2008 (16. desember 2008)
- SI Troyanov, Zhurnal Neorganicheskoi Khimii 37 , 266 (1992)
- Sohrabi Y, Shokoohizadeh MJ, Tabar FR, Mirzaei N, Bagheri A, Ghadiri SK, ... & Charganeh SS (2018) Kartlegging av bruken av aluminiumklorid i vannbehandling . Avansert vitenskapelig forskning ( abstrakt ).