Hydrogenklorid
| Hydrogenklorid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikasjon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC-navn |
saltsyre hydrogenkloridet |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.028.723 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 231-595-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Utseende | gass, fargeløs, med en skarp lukt. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kjemiske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formel |
H Cl [isomerer] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molarmasse | 36,461 ± 0,002 g / mol H 2,76%, Cl 97,23%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | -4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dipolar øyeblikk | 1,1086 ± 0,0003 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysiske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fusjon | −114 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° kokende | ved 101,3 kPa : −85 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Løselighet | i vann ved 20 ° C : 720 g · l -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumisk masse |
1.00045 g · l -1 (gass)
ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mettende damptrykk |
ligning:

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritisk punkt | 51,35 ° C , 8,26 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trippel punkt | 160 K ( −114 ° C ), 13,8 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lydens hastighet | 296 m · s -1 ( 0 ° C , 1 atm ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termokjemi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 gass, 1 bar | 186,90 J · K- 1 - mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 gass | -92,31 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vap H ° |
16,15 kJ · mol -1 ( 1 atm , -85 ° C ); 9,08 kJ · mol -1 ( 1 atm , 25 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C s | 29,14 J / mol K ( 25 ° C )
ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forholdsregler | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Fare H314, H331, H314 : Gir alvorlige etseskader på huden og øyeskader H331 : Giftig ved innånding |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   A, D1A, E, A : Komprimert gass Absolutt damptrykk ved 50 ° C = 7950 kPa D1A : Meget giftig materiale med alvorlige øyeblikkelige effekter Transport av farlig gods: klasse 2.3 E : Etsende materiale Transport av farlig gods: klasse 8 Opplysning ved 1,0% i henhold til ingrediensinformasjonen liste |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 3 1 W | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transportere | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
268 : giftig og etsende gass UN-nummer : 1050 : ANHYDROUS HYDROGEN CHLORIDE Klasse: 2.3 Klassifiseringskode: 2TC : Flytende gass, giftig, etsende; Etiketter: 2.3 : Giftige gasser (tilsvarer gruppene betegnet med store bokstaver T, dvs. T, TF, TC, TO, TFC og TOC). 8 : Etsende stoffer  
2186 : VÆSKEKLORID, KJØLET VÆSKE Klasse: 2.3 Klassifiseringskode: 3TC : Kjølt flytende gass, giftig, etsende; Etiketter: 2.3 : Giftige gasser (tilsvarer gruppene betegnet med store bokstaver T, dvs. T, TF, TC, TO, TFC og TOC). 8 : Etsende stoffer   I henhold til kapittel 2.2.2.2.2 er hydrogenklorid i kjølt flytende form ikke tillatt for transport av ADR " ADR 2021 Vol 1 " [PDF] , FN,2020( ISBN 978-92-1-139177-0 , konsultert 30.04.21 ) , s. 136 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Innånding | bringe til frisk luft, muligens hjerte-lungeredning | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hud | Fjern tilsmussede klær, vask med rikelig med vann, vis lege | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Øyne | vask med rikelig med vann mens du holder øyelokkene åpne, vis en øyelege | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Svelging | ikke drikk, ikke fremkall brekninger, kontakt lege. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Økotoksikologi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Luktterskel | lav: 0,25 ppm høy: 10,06 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Enheter av SI og STP med mindre annet er oppgitt. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Den hydrogenklorid , kjemisk symbol H Cl , er et legeme bestående av klor og hydrogen , fargeløs, giftig og sterkt etsende . Under omgivelsestemperatur og trykkforhold er det en gass som danner hvite røyk ved kontakt med fuktighet . Disse røykene består av saltsyre , en ionisk løsning av hydrogenklorid i vann.
Hydrogenklorid, som saltsyre , er et viktig kjemikalie innen kjemi , industri eller vitenskap. Navnet HCl refererer noen ganger upassende til saltsyre i stedet for rent hydrogenklorid. Kjemikere snakker noen ganger om gassformig eller vannfri saltsyre for å referere til hydrogenklorid.
Historie
Hydrogenklorid har vært kjent siden de middelalder , når alkymister visste at saltsyre (da kjent som ånd salt eller acidum Salis ) ble i visse tilfeller bundet til damp såkalte marine sur gass .
For å XVII th århundre , Johann Rudolf Glauber brukes salt ( natriumklorid ) og svovelsyre for å fremstille natriumsulfat , sammen med den sekundære reaksjonsprodukt av hydrogenkloridet:
2 NaCl + H 2 SO 4 → 2 HCI + Na 2 SO 4.Noen ganger tilskrives denne oppdagelsen Carl Wilhelm Scheele , som også utførte denne reaksjonen i 1772. Joseph Priestley fikk rent hydrogenklorid i 1772, og i 1818 demonstrerte Humphry Davy at denne gassen er sammensatt av hydrogen og klor .
Under den industrielle revolusjonen ble etterspørselen etter alkaliske stoffer , og spesielt natriumkarbonat, mer og mer viktig. Nicolas Leblanc utviklet en ny industriell prosess for produksjon av natriumkarbonat . I Leblanc-prosessen omdannes salt ( natriumklorid ) til natriumkarbonat ved bruk av svovelsyre , kritt og trekull , med sekundærproduksjon av hydrogenklorid. Inntil lovfesting i Storbritannia av Alkali loven i 1863, sistnevnte ble sluppet ut i luften. Produsentene av natriumkarbonat måtte deretter oppløse det i vann , noe som gjorde det mulig å produsere saltsyre i industriell skala. Senere ble Hargreaves-prosessen utviklet, i likhet med Leblanc-prosessen, bortsett fra at svovelsyren erstattes av svoveldioksid , vann og luft . Ved begynnelsen av XX th -tallet , ble det Leblanc prosessen erstattes av Solvay-prosess som ikke produserer hydrogenklorid. Imidlertid er hydrogenklorid fremdeles et trinn i produksjonen av saltsyre .
Kjemi
Den molekyl HCl hydrogenklorid er en toatomig bestående av ett atom av hydrogen H og et atom av klor Cl, forbundet med en enkeltbinding . Siden klor er mye mer elektronegativ enn hydrogen, er bindingen polarisert. Som et resultat bærer molekylet et stort dipolmoment , med en negativ delvis ladning δ - båret av kloratomet og en positiv delvis ladning δ + båret av hydrogenatomet. Hydrogenklorid er derfor et polært molekyl . Det er veldig løselig i vann og i polare løsemidler .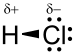
I kontakt med vann, hydrogenklorid ioniserer for å danne Cl - klorid -anioner og hydronium- H 3 O + kationer (H + solvatert ):
HCl + H 2 O → H 3 O + + Cl -Løsningen som følge av reaksjonen kalles saltsyre . Det er en sterk syre , som betyr at den surhet konstanten K en (som er relatert til den dissosiasjonsgraden av HCl-molekyl) er meget høy: hydrogenklorid dissosierer nesten helt i vann.
Selv i fravær av vann virker hydrogenklorid fortsatt som en syre . For eksempel kan HCl oppløses i andre løsningsmidler som metanol og protonater eller molekyler, og fungerer som en katalysatorsyre for visse kjemiske reaksjoner der vannfrie forhold (fullstendig fravær av vann) kreves:
HCl + CH 3 OH → CH 3 O + H- 2 + Cl -(protonering av HCl fra et metanolmolekyl CH 3 OH)På grunn av sin sure natur, er hydrogenklorid en korrosiv gass , særlig i nærvær av fuktighet ( 2- - 5 ppm av vann er tilstrekkelig).
Produksjon
Det meste av hydrogenkloridet som produseres i industrien brukes til produksjon av saltsyre .
En vanlig metode for å produsere hydrogenklorid i industrien er "HCl-ovnen", der dihydrogen og gassformig klor reagerer i en eksoterm reaksjon for å danne hydrogenklorid:
Cl 2 + H 2 → 2 HClDenne reaksjonen brukes til å produsere et veldig rent produkt, spesielt beregnet på næringsmiddelindustrien.
Hydrogenklorid kan også produseres fra klor og forbindelser som inneholder hydrogen, for eksempel hydrokarboner . Klorering av organiske forbindelser kan føre til produksjon av hydrogenklorid:
RH + Cl 2 → R-Cl + HClReaksjon av klorerte produkter med hydrogenfluorid for å danne fluorerte forbindelser gir også hydrogenklorid:
R-Cl + HF → RF + HClNår disse reaksjonene finner sted i vannfritt medium (fravær av vann), dannes gassformig HCl.
Hydrogenklorid kan også produseres i industriell skala fra natriumklorid (NaCl) og svovelsyre :
2 NaCl + H 2 SO 4 → 2 HCI + Na 2 SO 4 .
Syntese av hydrogenklorid
Hydrogenkloridet kan syntetiseres ved langsom tilsetning av vann (eller syre ) til noen klorerte overskudd av reagenser, slik som fosfor-klorid , den tionylklorid (SOCh 2 ) eller acylklorider . Tilsetning av for mye vann kan føre til oppløsningen av dannet hydrogenklorid og dannelse av saltsyre . For eksempel fører langsom tilsetning av kaldt vann til fosforpentaklorid til dannelsen av følgende HCl:
PCL 5 + H 2 O → POCh 3 + 2 HClTilsetning av varmt vann gjør det mulig å oppnå mer HCl ved å hydrolysere PCl 5 til fosforsyre . Den kjemiske reaksjon mellom vann og PCl 3 fosfortriklorid produserer også HCl.
Reaksjonen av tionylklorid med vann gir HCl så vel som svoveldioksid SO 2 . For reaksjoner tionylklorid eller acylklorider med vann, se tionylklorid og acylklorid .
HCl-generator
Det er mulig å tilberede små mengder HCl for bruk i laboratoriet ved hjelp av en HCl-generator i henhold til forskjellige metoder:
- frigjøring fra konsentrert saltsyre ved bruk av konsentrert svovelsyre .
- frigjøring fra konsentrert saltsyre ved bruk av vannfritt kalsiumklorid .
- ved å omsette svovelsyre og natriumklorid følgende: NaCl + H 2 SO 4 → NaHSO 4 + HCI ↑
Vanligvis tilsettes saltsyre eller svovelsyre dråpevis til reagenset i en kolbe. HCl kan tørkes ved å boble det gjennom konsentrert svovelsyre.
Bruker
Historisk anvendelser av hydrogenklorid i løpet av XX th tallet omfatter hydroklorering av alkyner til fremstilling av monomere klor kloropren og vinylklorid , som deretter polymeriseres for å gjøre polykloropren ( neopren ) og polyvinylklorid (PVC). For fremstilling av vinylklorid, acetylen (C 2 H 2 ) gjennomgår tilsetning av HCl på trippelbindingen for å danne vinylklorid.
"Acetylenprosessen", som ble brukt siden 1960-tallet for å produsere kloropren, begynner med omsetning av to acetylenmolekyler . Mellomproduktet som oppnås gjennomgår en tilsetning av HCl på trippelbindingen som fører til kloropren:

Acetylenprosessen har blitt erstattet av en fremgangsmåte hvor Cl 2 legger til en av dobbeltbindingene i 1,3- butadien , etterfulgt av fjerning som produserer kloropren og HCl.
For tiden er de viktigste anvendelsene av hydrogenklorid:
- hovedsakelig saltsyreproduksjon
- hydroklorering av gummi
- produksjon av vinylklorid og alkylklorid
- bomull behandling
- i halvlederindustrien .
Helseeffekter

Hydrogenklorid danner saltsyre ved kontakt med kroppsvev. Innåndingen kan forårsake hoste, kvelning, betennelse i neseveggene, halsen og luftveiene. I de mest alvorlige tilfellene kan det føre til lungeødem , kardiovaskulær systemsvikt og død. Hydrogenklorid kan forårsake alvorlige etseskader og irreversible øyeskader. Den skal bare brukes i et godt ventilert rom og med en maske.
Se også
Merknader og referanser
- HYDROGEN CHLORIDE , sikkerhetsark (er) til det internasjonale programmet for kjemisk sikkerhet , konsultert 9. mai 2009
- (i) David R. Lide, håndbok for kjemi og fysikk , Boca Raton, CRC,16. juni 2008, 89 th ed. , 2736 s. ( ISBN 978-1-4200-6679-1 ) , s. 9-50
- beregnede molekylmasse fra " atomvekter av elementene 2007 " på www.chem.qmul.ac.uk .
- (no) Robert H. Perry og Donald W. Green , Perrys Chemical Engineers 'Handbook , USA, McGraw-Hill,1997, 7 th ed. , 2400 s. ( ISBN 0-07-049841-5 ) , s. 2-50
- (in) Klotz, Irving M. / Rosenberg, Robert M., Chemical Thermodynamics, Basic Concepts and Methods , Wiley-VCH Verlag GmbH & Co. KGaA,2008, 564 s. ( ISBN 978-0-471-78015-1 og 0-471-78015-4 ) , s. 98
- (in) W. M Haynes, Handbook of Chemistry and Physics , CRC, 2010-2011 91 th ed. , 2610 s. ( ISBN 978-1-4398-2077-3 ) , s. 14-40
- (in) David R. Lide, CRC Handbook of Chemistry and Physics , CRC Press,2009, 90 th ed. , 2804 s. , Innbundet ( ISBN 978-1-4200-9084-0 )
- "Hydrogen chloride" , på ESIS , åpnet 19. februar 2009
- Indeksnummer i tabell 3.1 i vedlegg VI til EF-forskrift nr. 1272/2008 (16. desember 2008)
- " Hydrogenklorid " i databasen over kjemiske produkter Reptox fra CSST (Quebec-organisasjonen med ansvar for arbeidsmiljø og helse), åpnet 25. april 2009
- “ Hydrogen chloride, ” på hazmap.nlm.nih.gov (åpnet 14. november 2009 )
- " Hydrogen chloride " , fra Chemical Company of France ,4. juli 2016(åpnet 4. juli 2016 )







