Sulfurylklorid
| Sulfurylklorid | |
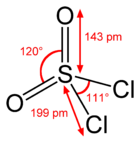  Struktur av sulfurylklorid |
|
| Identifikasjon | |
|---|---|
| IUPAC-navn | Sulfurylklorid |
| Synonymer |
Svovelklorid |
| N o CAS | |
| N o ECHA | 100.029.314 |
| N o EC | 232-245-6 |
| Kjemiske egenskaper | |
| Brute formel | SO 2 Cl 2 |
| Molarmasse | 134,97 ± 0,01 g / mol Cl 52,53%, O 23,71%, S 23,76%, |
| Fysiske egenskaper | |
| T ° fusjon | −54,1 ° C |
| T ° kokende | 69,4 ° C |
| Volumisk masse | 1667 kg · m -3 til 20 ° C |
| Forholdsregler | |
| Direktiv 67/548 / EØF | |
 VS Indeksnummer : Symboler : C : Etsende R-setninger : R14 : Reagerer voldsomt med vann. R34 : Gir etseskader. R37 : Irriterer luftveiene. S-setninger : S26 : I tilfelle kontakt med øynene, skyll umiddelbart med mye vann og kontakt lege. S45 : I tilfelle en ulykke eller hvis du føler deg uvel, kontakt lege umiddelbart (vis etiketten der det er mulig). (S1 / 2) : Holdes låst og utilgjengelig for barn. R-setninger : 14, 34, 37, S-setninger : (1/2), 26, 45, |
|
| Enheter av SI og STP med mindre annet er oppgitt. | |
Den sulfurylklorid er en uorganisk forbindelse av familien av oksyder , av formelen SO 2- Cl 2-. Det ser ut som en fargeløs væske med en skarp lukt. Det finnes ikke i naturen på grunn av den veldig raske hydrolysen .
Det forveksles ofte med tionylklorid SOCl 2, men disse to svoveloksykloridene har forskjellige egenskaper: tionylklorid produserer kloridioner Cl - mens sulfurylklorid gir klor Cl 2.
Forberedelse og reaksjoner
Sulfurylklorid fremstilles ved omsetning av svoveldioksid SO 2og klor Cl 2i nærvær av en katalysator , slik som aktivert karbon :
SO 2+ Cl 2→ SO 2 Cl 2.Det erholdte produkt kan deretter renses ved fraksjonert destillasjon .
Svovelklorid reagerer voldsomt med vann som frigjør hydrogenklorid HC1 og gir svovelsyre H 2 SO 4 :
2 H 2 O+ SO 2 Cl 2→ 2 HCl + H- 2 SO 4Den nedbrytes under varme, rundt 100 ° C , eller omtrent 30 ° C over kokepunktet. Den nedbrytes også sakte ved romtemperatur for å gi svoveldioksid SO 2og klor Cl 2, ved opphavet til den svake gulaktige fargen på sulfurylkloridprøvene som har hatt tid til å "eldes".
applikasjoner
I den grad sulfurylklorid er flytende, er det funnet mer praktisk å håndtere enn klor , som er gassformig, noe som gjør bruken som klorkilde lett å transportere, lagres og måles. Det brukes også til å klorinere alkaner , alkener , alkyner , arener og epoksider , i henhold til radikale reaksjoner initiert av AIBN . Det kan også omdanne alkoholer til organokloriner .
I industrien brukes sulfurylklorid hovedsakelig til fremstilling av plantevernmidler.
sikkerhet
Sulfurylklorid er giftig, etsende og tåregass. Det er sannsynlig å danne eksplosive blandinger med vann, samt med dimetylsulfoksid O = S (CH 3 ) 2(DMSO) og dimetylformamid OHC - N (CH 3 ) 2 (DMF).
Merknader og referanser
- beregnede molekylmasse fra " atomvekter av elementene 2007 " på www.chem.qmul.ac.uk .