Oksaloeddiksyre
| Oksaloeddiksyre | |||

| |||
| Struktur av oksaloeddiksyre | |||
| Identifikasjon | |||
|---|---|---|---|
| IUPAC-navn | 2-oksobutandisyre | ||
| Synonymer |
2-oksosavsyre |
||
| N o CAS | |||
| N o ECHA | 100,005,755 | ||
| N o EC | 206-329-8 | ||
| PubChem | 970 | ||
| ChEBI | 30744 | ||
| SMIL |
OC (= O) CC (= O) C (O) = O , |
||
| InChI |
InChI: InChI = 1 / C4H4O5 / c5-2 (4 (8) 9) 1-3 (6) 7 / h1H2, (H, 6,7) (H, 8,9) Std. InChI: InChI = 1S / C4H4O5 / c5-2 (4 (8) 9) 1-3 (6) 7 / h1H2, (H, 6,7) (H, 8,9) Std. InChIKey: KHPXUQMNIQBQEV-UHFFFAOYSA-N |
||
| Kjemiske egenskaper | |||
| Brute formel |
C 4 H 4 O 5 [Isomerer] |
||
| Molarmasse | 132,0716 ± 0,005 g / mol C 36,38%, H 3,05%, O 60,57%, |
||
| Fysiske egenskaper | |||
| T ° fusjon | 161 ° C dek | ||
| Forholdsregler | |||
| SGH | |||
 Fare H314, P280, P310, P305 + P351 + P338, H314 : Gir alvorlige etseskader på huden og øyeskader P280 : Bruk vernehansker / verneklær / øyevern / ansiktsbeskyttelse. P310 : Kontakt et GIFTINFORMASJONSSENTER eller lege. P305 + P351 + P338 : Ved øyne: Skyll forsiktig med vann i flere minutter. Fjern kontaktlinser hvis offeret bruker dem og de lett kan fjernes. Fortsett å skylle. |
|||
| WHMIS | |||
|
Ukontrollert produktDette produktet er ikke kontrollert i henhold til WHMIS-klassifiseringskriteriene. |
|||
| Transportere | |||
3261 : CORROSIVE SOLID, SUR, nos Klasse: 8 Label: 8 : etsende materiale Emballasje: Emballasjegruppe II : medium farlige stoffer;  |
|||
| Enheter av SI og STP med mindre annet er oppgitt. | |||
Den oksaloeddiksyre hvis korresponderende base er den oksaloacetat , er en dikarboksylsyre med formel HOOC-CO-CH 2- COOH. Dette er et krystalliserbart stoff som vises spesielt som mellomprodukt i Krebs-syklusen , glukoneogenesen , urea-syklusen , glykoksylatsyklusen , biosyntese av fettsyrer , og den til noen aminosyrer .
Deprotonation
Oksaloeddiksyre gjennomgår to påfølgende deprotoneringer for å føre til dianionen :
HOOC - CO - CH 2 –COOH - OOC - CO - CH 2 –COOH, p K a = 2,22 - OOC - CO - CH 2 –COOH - OOC - CO - CH 2 –COO -, p K a = 3,89Ved høy pH blir det enoliserbare protonet også labilt :
- OOC - CO - CH 2 –COO - - OOC - CO - = CH - COO - , p K a = 13,03De enoliske formene av oksaloacetat er spesielt stabile, så mye at cis- og trans- isomerer har to forskjellige smeltetemperaturer : 152 ° C for cis- isomeren og 184 ° C for trans- isomeren .
Biosyntese
Oksaloacetat produseres naturlig på en rekke måter. Den viktigste av disse er oksydasjon av L -malat med malat dehydrogenase i 10 th og siste trinnet i Krebs syklus :

|
+ NAD + NADH + H + + |
|
| L -Mate | Oksaloacetat | |
| Malat dehydrogenase - EC | ||
Den L -malat er også langsomt oksyderes enol-oksaloacetat - OOC-COH = CH-COO - ved den succinat dehydrogenase gjennom en promiskuøs reaksjon av enol-oksaloacetat omdannes deretter til oksaloacetat av oksaloacetat tautomerase .
Oksaloacetat dannes også ved kondensering av pyruvat CH 3 –CO - COO -med bikarbonat HCO 3 -og samtidig hydrolyse av et ATP- molekyl . Denne reaksjonen finner sted i den mesophyll av plantene via den fosfoenolpyruvat ved virkning av pyruvat-carboxylase :
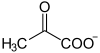
|
+ HCO 3 -+ ATP ADP + Pi + |
|
| Pyruvat | Oksaloacetat | |
| Pyruvat karboksylase - EC | ||
Det dannes også ved transaminering av aspartat :
|
|
+ |
|
|
+ |
|
|
| Aspartat | α-ketoglutarat | Oksaloacetat | Glutamat | |||
| Aspartataminotransferase (AST) - EC | ||||||
Biokjemiske funksjoner
Oksaloacetat er et mellomprodukt i Krebs-syklusen , der det reagerer med acetyl-CoA for å danne sitrat under virkningen av sitratsyntase . Det er også involvert i glukoneogenese , urea-syklusen , glyoksylatsyklusen , biosyntese av aminosyrer og fettsyrebiosyntesen .
Oksaloacetatet er også en hemmer kraftig av succinatdehydrogenase (kompleks II i luftveiskjeden ).
Krebs sykler
Oksaloacetat er metabolitten som lukker Krebs-syklusen : det er virkelig et substrat for den første reaksjonen av syklusen, for å danne sitrat ved reaksjon med acetyl-CoA under påvirkning av sitratsyntase , og c 'er også et produkt av den siste reaksjonen av syklusen, ved oksidasjon av L- malat under påvirkning av malatdehydrogenase .
|
|
+ Acetyl-CoA + H 2 O → CoA + |

|
| Oksaloacetat | Sitrat | |
| Sitratsyntase - EC | ||
Glukogenese
Den glukoneogenese som er en vei som omfatter elleve reaksjoner katalysert ved enzymer og å tillate biosyntese av glukose fra forløpere ikke karbohydrat . Det begynner i mitokondrie-matrisen , der pyruvat ligger . Den sistnevnte blir omdannet til oksaloacetat av pyruvat-carboxylase med samtidig hydrolyse av en ATP -molekyl , så den oxaloacetat blir redusert til L -malat av mitokondriell malatdehydrogenase inn for å være i stand til å krysse den indre mitokondrie-membran og få det cytosolen . Der oksyderes L- malatet til oksaloacetat igjen av den cytosoliske isoformen av malatdehydrogenase. Det er fra cytosolisk oksaloacetat at ytterligere glukoneogenese fører til glukose.
Urea syklus
Den urea syklus frembringer et molekyl av urea fra et anion bikarbonat HCO 3 -og to NH 4 + ammonium- kationer . Denne metabolske veien foregår vanligvis i hepatocytter , fra NADH , en av produksjonsmetodene som involverer oksidasjon av L- malat til oksaloacetat av malatdehydrogenase . Dette cytosol L- malatet er avledet fra fumarat under påvirkning av fumarase , mens oksaloacetat omdannes til aspartat av en transaminase , som opprettholder strømmen av nitrogen i cellen .
Glykoksylatsyklus
Den glyoksylat syklusen er en variant av Krebs syklus som involverer isocitrat lyase og malat syntase og bidra til anabolisme av planter og bakterier . Noen trinn i denne syklusen skiller seg litt fra Krebs-syklusen, men oksaloacetat fungerer som sluttprodukt og første reaktant i begge sykluser, bortsett fra at det er et nettoprodukt av glyoksylat-syklusen fordi sistnevnte inneholder to molekyler acetyl-CoA , ikke bare en som Krebs-syklusen.
Biosyntese av fettsyrer
I denne prosessen blir acetyl-CoA først overført fra mitokondrie-matrisen til cytosolen , hvor fettsyresyntase er funnet , som sitrat etter reaksjon med oksaloacetat under påvirkning av sitratsyntase . Citrat krysser den indre mitokondrielle membranen ved hjelp av mitokondrie-trikarboksylat-transportproteinet (en) . En gang i cytosolen spaltes citratet igjen i oksaloacetat og acetyl-CoA ved ATP-citratlyase .
En del av den reduserende kraften som er nødvendig for fettsyrebiosyntese , brukt i form av NADPH , genereres fra cytosolisk NADH når oksaloacetat returnerer til mitokondriell matrise. Oksaloacetat reduseres først til L- malat av malatdehydrogenase fra et NADH-molekyl, deretter dekarboksyleres L- malat til pyruvat av malic-enzymet i NADP , en reaksjon der et molekyl av NADP + reduseres til NADPH; pyruvat kan deretter komme inn i mitokondriell matrise gjennom den indre membranen i mitokondriene.
Aminosyre biosyntese
Seks essensielle aminosyrer og tre ikke-essensielle aminosyrer er avledet fra oksaloacetat og pyruvat . Dermed blir aspartat og alanin henholdsvis dannet av oksaloacetat og pyruvat ved transaminering fra glutamat . Aspartat kan deretter omdannes til asparagin , metionin , lysin og treonin , noe som gjør det viktig for produksjonen av disse proteinogene aminosyrene .
Merknader og referanser
- beregnede molekylmasse fra " atomvekter av elementene 2007 " på www.chem.qmul.ac.uk .
- Sigma-Aldrich- ark av forbindelsen oksaloeddiksyre ≥ 97% (HPLC) , åpnet 16. juli 2016.
- " Oksaleddiksyre " i databasen over kjemikalier Reptox fra CSST (Quebec-organisasjonen som er ansvarlig for arbeidsmiljø og helse), åpnet 25. april 2009
- (in) MV Panchenko og AD Vinogradov , " Direkte demonstrasjon av enol- oksaloacetatår som øyeblikkelig produkt av malatoksidasjon av succinatdehydrogenase pattedyr " , FEBS Letters , vol. 286, n bein 1-2, 29. juli 1991, s. 76-78 ( PMID 1864383 , DOI 10.1016 / 0014-5793 (91) 80944-X , les online )
- (in) G. Wiegand og SJ Remington , " Citrate Synthase: Structure, Control and Mechanism " , Årlig gjennomgang av biofysikk og biofysisk kjemi , vol. 15, Juni 1986, s. 97-117 ( PMID 3013232 , DOI 10.1146 / annurev.bb.15.060186.000525 , les online )
