Furan
| Furan | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Furan-molekyl |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikasjon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Synonymer |
Furfuranne |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100,003,390 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 203-727-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 8029 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 35559 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMIL |
C1 = COC = C1 , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / C4H4O / c1-2-4-5-3-1 / h1-4H Std. InChI: InChI = 1S / C4H4O / c1-2-4-5-3-1 / h1-4H Std. InChIKey: YLQBMQCUIZJEEH-UHFFFAOYSA-N |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Utseende | klar fargeløs væske som gradvis blir brun med en karakteristisk lukt. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kjemiske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formel |
C 4 H 4 O [Isomerer] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molarmasse | 68,074 ± 0,0038 g / mol C 70,57%, H 5,92%, O 23,5%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dipolar øyeblikk | 0,66 ± 0,01 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molekylær diameter | 0,502 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysiske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fusjon | −85,6 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° kokende | 31,5 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Løselighet | 10 g · l -1 (vann, 20 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Løselighetsparameter δ |
19,2 MPa 1/2 ( 25 ° C ); 18,6 J 1/2 · cm -3/2 ( 25 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumisk masse |
0,9644 g · cm -3 ( 0 ° C )
ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Selvantennelsestemperatur | 390 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Flammepunkt | −35 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eksplosjonsgrenser i luft | 2,3 - 14,3 % vol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mettende damptrykk |
0,658 bar ved 20 ° C 1,0 bar ved 30 ° C 1,907 bar ved 50 ° C 3,105 bar ved 65 ° C ligning:
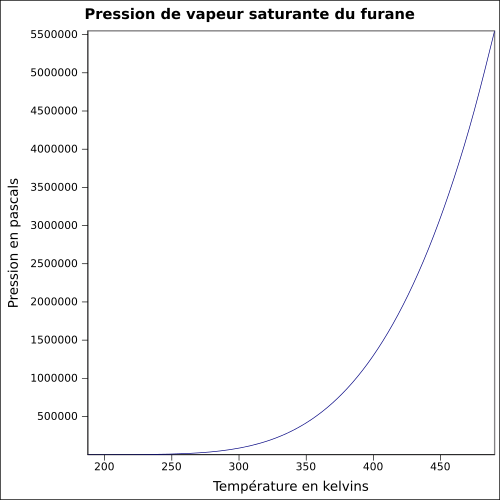
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritisk punkt | 55,0 bar , 217,05 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termokjemi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C s |
ligning:
ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroniske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re ioniseringsenergi | 8,883 ± 0,003 eV (gass) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Optiske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brytningsindeks | 1.4187 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forholdsregler | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Fare H224, H302, H315, H332, H341, H350, H373, H412, EUH019, P201, P210, P261, P273, P281, P311, H224 : Ekstremt brannfarlig væske og damp H302 : Farlig ved svelging H315 : Gir hudirritasjon H332 : Farlig ved innånding H341 : Mistenkes å forårsake genetiske defekter (angi eksponeringsvei hvis det er endelig bevist at ingen annen eksponeringsvei fører til samme fare ) H350 : Kan forårsake kreft (angi eksponeringsvei hvis det er endelig bevist at ingen annen eksponeringsvei forårsaker samme fare) H373 : Antatt risiko for '' alvorlige effekter på organene (liste opp alle berørte organer, hvis kjent) etter gjentatt eksponering eller langvarig eksponering (indikerer svei dersom det er bevist at ingen annen rute eksponering ikke fører til like miljøskadelig) H412 : Skadelig for vannlevende organismer med langvarige EUH019 : Kan danne eksplosive peroksider P201 : Innhent spesielle opplysninger før bruk. P210 : Holdes borte fra varme / gnister / åpen ild / varme overflater. - Røyking forbudt. P261 : Unngå å puste inn støv / røyk / gass / tåke / damp / spray. P273 : Unngå utslipp til miljøet. P281 : Bruk nødvendig personlig verneutstyr. P311 : Ring et GIFTINFORMASJONSSENTER eller lege. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B2, D1A, D2A, B2 brannfarlig væske D1a : meget giftig materiale forårsaker umiddelbar alvorlige effekter D2A : meget giftig materiale forårsaker andre toksiske virkninger Disclosure ved 0,1% i henhold til klassifiseringskriterier |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 2 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transportere | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
33 : lettantennelig flytende materiale (flammepunkt under 21 ° C ) FN-nummer : 2389 : FURANNE Klasse: 3 Etikett: 3 : Brannfarlige væsker Emballasje: Emballasjegruppe I : veldig farlig gods ;  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IARC- klassifisering | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe 2B: Muligens kreftfremkallende for mennesker | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Økotoksikologi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL 50 |
7 mg · kg -1 (Mus, ip ) 5,2 mg · kg -1 (Rotter, ip ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CL 50 | Rotte: 20 ppm i 4 timer | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 1.34 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Enheter av SI og STP med mindre annet er oppgitt. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Den furan , skriver furan , er en kjemisk forbindelse med empirisk formel C 4 H 4 O. Det er en heterosyklisk forbindelse som tilhører klassen metalloler , bestående av en aromatisk ring med fem atomer , inkludert et oksygenatom . Det er i form av en væske som er svært flyktig, fargeløs. Besitter en reaktivitet som er forskjellig fra benzen , og brukes som et reagens eller forløper i organisk kjemi .
Syntese
Furan ble først syntetisert i 1870 av Heinrich Limpricht og ble da kalt tetrafenol .
Industriell syntese
En av de viktigste kildene til furan er furfuraldehyd , oppnådd ved destillasjon av plantederivater, spesielt korn. Furfuraldehydet katalyseres deretter dekarboksyleres for å produsere furan. To syntetiske ruter er kjent:
- Den opprinnelige metoden transformasjonene furfuraldehyd til furan, hydrogen H 2og karbondioksid CO 2i nærvær av vanndamp H 2 Oog en katalysator av Zn - Fe eller Zn - Mn . Damp-furfural-blandingen med forholdet 1: 5-1: 10 oppvarmes til 400 ° C, og furanutbyttet er større enn 90%.
- I 1959 utviklet DuPont en syntetisk rute ved hjelp av en platinakatalysator , som gjorde det mulig å unngå bruk av damp. Furfural er direkte dekomponeres til furan og karbonmonoksyd trykk og CO ved en temperatur på 200 ° C .
En annen mulighet er delvis oksidasjon av 1,3-butadien . Denne teknikken ble utviklet av DuPont i 1957. Reaksjonen bruker et molybdenoksid MoO 3som en katalysator ved en temperatur på 500 ° C . Ulike katalysatorer tillater også denne reaksjonen: oksid av fosfor og vanadium eller oksid av antimon dopet med tinn , kobber eller til og med wolfram . Avkastningen er imidlertid mindre enn 15%.
DuPont fortsatte utviklingen langs denne banen, og i 1987 ble det utviklet en lav temperatur ( 90 til 120 ° C ) prosess. 1,3-butadienreagenset blir fordampet og deretter oksidert med kobberdiklorid i en vandig løsning av kobbermono- og diklorid med nærvær av natriumklorid, kaliumjodid og saltsyre. En selektivitet på mer enn 90% er rapportert for en omdannelse av 1,3-butadien på 20%.
Laboratoriesyntese
Furan og dets substituerte derivater kan fås fra åpne systemer, som gir direkte tilgang til høyt funksjonaliserte derivater, spesielt dehydrering av substituerte pentan-2,4-dioner gir tilgang til 3,4-furaner. Substituert, ganske komplisert å oppnå ved andre ruter. Den Paal-Knorr- syntesen er en av de enkleste syntesene og tillater fra en 1,4- diketon og fosforpentoksyd P 4 O 10 å få furan.
Den syntese av Feist-Benary omsetning av karbanionet av en β-ketoester med karbonylgruppen av en α-halogen-keton og en intramolekylær nukleofil substitusjon finner sted for å danne en ring som gir ved tørking en furan.
Andre synteser av furan er mulig fra cycloadditions eller Diels-Alder-reaksjoner .
Fysisk-kjemiske egenskaper
Furan er en fargeløs væske under normale temperatur- og trykkforhold . Den er veldig flyktig og har et lavt kokepunkt . I NMR av det proton , har furan to massetoppene i deuterert kloroform CDCb 3 : 7,4 ppm for α-hydrogenene av oksygen , 6,3 ppm for β-hydrogenene. I NMR av karbon presenterer furan to topper ved 142 ppm til karbon 1 og 5, 109 ppm til karbon 2 og 4. Furan er veldig løselig i aceton , løselig i metanol og i dietyleteren og veldig lett løselig i vann. Brytningsindeksen er 1.421.
Aromatisitet
Furan er en aromatisk forbindelse som respekterer Hückels styre . Den har seks delokaliserte elektroner: fire levert av dobbeltbindinger og to for oksygenatomet (en av de to ikke-bindende dublettene ). Hvert karbon bringer en av sine π-elektroner i delokaliseringen, og oksygen bringer to elektroner. Karbonene er sp 2 hybridiserte . Furan har en resonansenergi mellom 62,3 og 96,2 kJ mol −1 . Denne energien er lavere enn benzen , tiofen og pyrrol : furan er derfor en mindre aromatisk forbindelse enn sistnevnte. Denne lave aromatisiteten forklarer hvorfor furan fungerer som en syklisk dien i visse Diels-Alder-reaksjoner .
Den oksygenatom har en mesomeric donor effekt og en induktiv attraktor effekt på furan. Delokaliseringen av den ikke-bindende dubletten utgjør den mesomere effekten av oksygen, mens tiltrekningen av elektroner fra CO-bindingene mot oksygenatomet tilsvarer den induktive effekten . Den induktive tiltrekningspersonen påvirker fordelingen av elektroner i syklusen, men klarer ikke å motveie den mesomere effekten. Oksygenet gir derfor globalt en ekstra elektrondensitet i syklusen. Dette elektronbidraget av oksygen resulterer i elektrondensitetsverdier større enn 1 for karbonene i syklusen. Donorens mesomereffekt genererer en positiv ladning på oksygen i de fire mesomere formene av furan og en avlokalisert negativ ladning på ringkullene .
Oksygenatomet har en annen dublett som ikke delokaliseres. Furan er en plan forbindelse. I likhet med tiofen- eller pyrrol- kolleger , er syklusen elektrooverskudd. Den har faktisk seks π elektroner fordelt på fem atomer; elektrondensiteten er derfor markant høyere enn på benzenanaloger. På den annen side, i motsetning til enkle seksleddede aromatiske ringer, er bare en av dens resonansformer nøytrale, de andre eksisterer i zwitterionisk form . Ettersom disse ladede formene er i mindretall, er kjemien til furan delvis avledet fra aromater og delvis fra dienser.
Furan reaktivitet
De forskjellige typene reaktivitet
som aromatiskFuran er elektrooverskudd, de elektrofile aromatiske substitusjonsreaksjonene er markant raskere enn med benzenanaloger . Dermed er det mulig å utføre reaksjonene av halogenering , sulfonering , metallisering, etc. Furan er så reaktiv at den kan gjennomgå Friedel-Crafts-acyleringer uten tilstedeværelse av en katalysator .
De mest gunstige posisjonene for substitusjonsreaksjoner er posisjon 2 og 5 (i α av oksygen). Når begge er tilgjengelige, er det ganske vanskelig å stoppe ved monosubstitusjon. Når posisjon 2 og 5 er okkupert, finner reaksjonene sted på de gjenværende posisjonene.
som dienFuran og dets derivater kan reagere som diener eller ellers som aromatiske forbindelser avhengig av substituentene på ringen. Usubstituert furan reagerer spesielt godt som en dien i Diels-Alders- sykliseringsreaksjoner på grunn av den lave aromatisiteten. Likeledes, alkyl furaner, alkoksy furaner og furfuryl estere og eter har god reaktivitet i Diels-Alder-reaksjoner . Furosyrer, nitrofuraner og furfural har imidlertid elektronuttrekkende grupper og reagerer ikke engang med sterke dienofiler. Det kan reagere med maleinsyreanhydrid , maleat og fumarat under høyt trykk, akrylat med en katalysator ( sinkjodid ).
Fullstendig hydrogenering av furan gir tetrahydrofuran (THF), et løsningsmiddel som er mye brukt i organisk kjemi og farmasøytiske produkter.
som eterFuran er en syklisk eter . Det er spesielt følsomt for åpninger i et surt vandig medium. Det er spesielt kilden til side-reaksjoner, spesielt på halogenerte derivater, som er spesielt ustabile.
Regioselektivitet av substitusjoner
Posisjonen der en substitusjon vil finne sted avhenger av stabiliteten til reaksjonsmellomproduktet. Skriften av de mesomere former av mellomproduktene til en elektrofil substitusjon på furan viser at en substitusjon fortrinnsvis utføres i posisjon 2 eller 5 fordi det dannede mellomprodukt har tre mesomere former . Når substitusjonen finner sted i 3 eller 4 posisjon, har det dannede mellomproduktet bare to mesomere former og har mindre stabilitet.
Å skrive de mesomere formene gjør det mulig å lokalisere de delvise negative ladningene av furan i posisjonene 2, 3, 4 og 5. Blant de mesomere formene er den uladede formen mer representativ fordi den er mer stabil. Blant de mesomere skjemaene med ladninger, er de der ladningene er fjernest mer representative enn skjemaene der ladningene er nærme. Furan har bare en uladet mesomerform i motsetning til benzen, som har to uladede mesomere former.
Reaksjon med syrer
De mineralsyrer i vandig oppløsning fortynnes, kaldt ikke har innvirkning furan eller alkylfuranes. Men når de varmes opp protonerer de furan i posisjon 2, og produserer en åpning av furan og dannelse av dikarbonylforbindelser. I tillegg forårsaker sterke konsentrerte syrer ( svovelsyre , røykende salpetersyre ) eller Lewis-syrer polymerisering av furan og dens alkylderivater.
Furansubstituentene påvirker reaktiviteten mot syrer . Furaner erstattet av elektronuttrekkende grupper er relativt stabile i et surt medium fordi ringen er mindre elektronisk ladet og derfor mindre reaktiv. På den annen side åpnes eller polymeriseres furaner som er substituert med elektron-donorgrupper i et surt medium. Faktisk letter elektrondonersubstituentene angrepet av et proton i posisjon 2 i furan.
Aromatisk nukleofil substitusjon
Furan reagerer ikke med nukleofile reagenser. Imidlertid kan visse furaner som har elektronuttrekkende grupper gjennomgå nukleofil substitusjon av disse gruppene.
Aromatisk elektrofil erstatning
Furan er mer reaktiv enn tiofen og benzen mot elektrofile reagenser, men mindre reaktiv enn pyrrol .
Den furan Nitreringen utføres med eddiksyreanhydrid H 3 C - CO - O - CO - CH 3og salpetersyre HNO 3ved lav temperatur. 2-nitrofuran dannes først, og deretter, hvis reaksjonen fortsetter, 2,5-dinitrofuran. Nitrering danner en ikke-aromatisk, isolerbar forbindelse som kan miste et molekyl av eddiksyre CH 3 COOHved virkning av en base slik som pyridin eller ved solvolyse .
Den sulfoneringen blir utført ved romtemperatur, ved virkningen av de pyridin - svoveltrioksyd- kompleks for å fremstille en forbindelse monosulfonat.
Alkylering under Friedel-Crafts-forhold er ikke mulig og resulterer i en blanding av produkter og polymerer . Furan blir imidlertid acylert i nærvær av en Lewis-syre med klorider av syre eller anhydrider . Substitusjonen finner sted i posisjon 2. Vilsmeier-Haack-reaksjonen gjør det mulig å legge til en formylgruppe i posisjon 2 i furan. Mannich-reaksjonen fungerer ikke med furan, men gjelder alkylfuraner som har en fri 2 eller 5 posisjon.
bruk
Furan brukes hovedsakelig som en forløper i fine kjemikalier. Ved hydrogenering av furan kan tetrahydrofuran (THF) oppnås, som primært brukes som løsningsmiddel. Oksidasjon i nærvær av brom i metanol gir 2,5-dimetoksy-2,5-dihydrofuran , brukt i fotografering. Det er også en forløper for fytosanitære produkter som endothall .
Furan brukes også som en blokk for dannelse av polymerer som brukes som tilsetningsstoffer for rengjøringsprodukter og vaskemidler. Fordelen med slike tilsetningsstoffer er at de ikke inneholder nitrogen eller fosfor.
Toksikologi
Disse stoffene har en lipofil karakter (de oppløses i fett) og forurenser mennesker hovedsakelig gjennom fordøyelseskanalen (spesielt forurenset mat).
Under akutt forgiftning oppstår særlig kviser (klorakne) i ansiktet og kofferten. Perifer nerveskade oppstår også (prikking, smerter i hender eller føtter samt myotatiske refleksforstyrrelser). Hirsutisme er også beskrevet. Til slutt finner vi skade på leveren, blodsukkeret (diabetes) og fettmetabolismen.
En økning i kreft, uten spesifikk lokalisering, er kjent og gjelder hovedsakelig blod (lymfom, myelom), bløtvev, lunger og lever.
Forskrifter
- I 2011 oppdaterte EFSA sine data om furan nivåer i mat. På det nåværende tidspunkt er det imidlertid ingen forskrifter som fastsetter maksimale tillatte nivåer i næringsmidler.
I mangel av regulering er det nylig stilt spørsmålstegn ved kaffekapsler for tilstedeværelsen av furan. Imidlertid reduserer forurensningsnivået flere handlinger, for eksempel å gi frisk luft når du steker frøene (eller rører kaffen med en skje).
Bibliografi
- (fr) R. Milcent, F. Chau Organic Heterocyclic Chemistry , EDP Sciences.
Se også
Strukturelt eller kjemisk relaterte forbindelser:
- Tetrahydrofuran , mettet furan, mye brukt som løsemiddel
-
Substituerte furaner
- Furanose , furan substituert med hydroksylgrupper
- Furfural , furan erstattet av en aldehydgruppe
- Furonsyre , furan erstattet av en karboksylgruppe
- Furfurylalkohol
-
Furaner knyttet til sykluser
- Benzofuran , furan bundet til en benzen
- Dibenzofuran , furan knyttet til to benzener
- Polyklorerte dibenzo-furan
-
Furan-analoger
- Pyrrol , heterosyklisk med ett nitrogenatom
- Tiofen , heterosyklisk med ett svovelatom
- Heterocyklisk selenophene med et selenatom
- Heterocyklisk tellurophene med en tellur -atom
Referanser
- FURANNE , sikkerhetsark (er) til det internasjonale programmet for sikkerhet for kjemiske stoffer , konsultert 9. mai 2009
- (i) David R. Lide, håndbok for kjemi og fysikk , Boca Raton, CRC, 16. juni 2008, 89 th ed. , 2736 s. ( ISBN 978-1-4200-6679-1 og 1-4200-6679-X ) , s. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents , vol. 4, England, John Wiley & Sons Ltd,1999, 239 s. ( ISBN 0-471-98369-1 )
- beregnede molekylmasse fra " atomvekter av elementene 2007 " på www.chem.qmul.ac.uk .
- (en) ChemIDplus , " Furan - RN: 110-00-9 " , på chem.sis.nlm.nih.gov , US National Library of Medicine (åpnet 17. desember 2008 )
- (in) James E. Mark, Physical Properties of Polymer Handbook , Springer,2007, 2 nd ed. , 1076 s. ( ISBN 978-0-387-69002-5 og 0-387-69002-6 , leses online ) , s. 294
- (in) JG Speight, Norbert Adolph Lange, Lange's Chembook , McGraw-Hill,2005, 16 th ed. , 1623 s. ( ISBN 0-07-143220-5 ) , s. 2.289
- (no) Robert H. Perry og Donald W. Green , Perrys Chemical Engineers 'Handbook , USA, McGraw-Hill,1997, 7 th ed. , 2400 s. ( ISBN 0-07-049841-5 ) , s. 2-50
- " Properties of Various Gases ", på flexwareinc.com (åpnet 12. april 2010 )
- (i) Carl L. yaws, Handbook of Thermodynamic diagrammer , vol. 1, Huston, Texas, Gulf Pub. Co.,1996( ISBN 0-88415-857-8 )
- (i) David R. Lide, håndbok for kjemi og fysikk , Boca Raton, CRC,2008, 89 th ed. , 2736 s. ( ISBN 978-1-4200-6679-1 ) , s. 10-205
- IARC arbeidsgruppe for evaluering av kreftfremkallende risikoer for mennesker, “ Evaluations Globales de la Carcinogenicité pour l'Homme, Groupe 2B: Eventuelt kreftfremkallende for mennesker ” , på http://monographs.iarc.fr , IARC, 16. januar 2009(åpnet 22. august 2009 )
- Indeksnummer i tabell 3.1 i vedlegg VI til EF-forskrift nr. 1272/2008 (16. desember 2008)
- Oppføring "Furan" i den kjemiske databasen GESTIS fra IFA (tysk instans med ansvar for arbeidsmiljø og sikkerhet) ( tysk , engelsk ), åpnet 19. april 2011 (JavaScript kreves)
- SIGMA-ALDRICH
- " Furanne " i databasen over kjemikalier Reptox fra CSST (Quebec-organisasjonen med ansvar for arbeidsmiljø og helse), åpnet 25. april 2009
- "furan" , på ESIS , åpnes den 17 februar 2009
- (en) H.Limpricht, " Ueber das tetraphenol C 4 H 4 O " , Berichte der deutschen chemischen Gesellschaft , vol. 3, n o 1, 1870, s. 90-91 ( DOI 10.1002 / cber.18700030129 )
- (en) HE Hoydonckx, WM Van Rhijn, W. Van Rhijn, DE De Vos og PA Jacobs, “Furfural and Derivatives” , i Ullmanns Encyclopedia of Industrial Chemistry ,2007( sammendrag )
- (in) Agency of Industrial Science and Technology , " Research Information Database RIO-DB Home Page " på http://riodb01.ibase.aist.go.jp , Tsukuba Advanced Computing Center (åpnet 14. juli 2008 )
- kjemiside http://www.sciencelab.com/xMSDS-Furan-9927174
- Sigma, http://www.sigmaaldrich.com/catalog/ProductDetail.do?N4=185922%7CALDRICH&N5=SEARCH_CONCAT_PNO%7CBRAND_KEY&F=SPEC
- Heterocyclic organisk kjemi grunnleggende strukturer, René Milcent, François Chau
- Heterochemistry-nettsted http://www.cem.msu.edu/~reusch/VirtualText/heterocy.htm
- (in) HR Kottke "Furan Derivatives" i "Kirk-Othmer Encyclopedia of Chemical Technology" 1998; John Wiley & Sons: New York
- Dioksiner og furaner. ED 5024. INRS. 2006
- EFSA 01/09/11 EFSA publiserer oppdatert rapport om furan nivåer i mat
- MS Altaki, FJ Santos, MT Galceran, “Forekomst av furan i kaffe fra det spanske markedet: bidrag fra brygging og steking”, Food Chemistry , 2011, 126 (4), 1527









