Etylenglykol
| Etylenglykol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struktur av etylenglykol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikasjon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC-navn | Etan-1,2-diol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonymer |
1,2-dihydroksyetan |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100,003,159 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 203-473-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMIL |
C (CO) O , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / C2H6O2 / c3-1-2-4 / h3-4H, 1-2H2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Utseende | fargeløs, tyktflytende, hygroskopisk væske. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kjemiske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formel |
C 2 H 6 O 2 [isomerer] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molarmasse | 62,0678 ± 0,0026 g / mol C 38,7%, H 9,74%, O 51,55%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysiske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fusjon |
−12,69 ° C ren −26 ° C ved 40% vol i vann |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° kokende | 197,3 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Løselighet | Blandbar med vann , glyserol , pyridin , aceton , aldehyder , eddiksyre . Lite jord i eter (1 av 200). Praktisk talt uløselig i benzen , oljer . | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Løselighetsparameter δ | 29,9 MPa 1/2 ( 25 ° C ); 32,4 J 1/2 cm −3/2 ( 25 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumisk masse |
1.127 4 g cm −3 ( 0 ° C ) 1.120 4 g cm −3 ( 10 ° C ) 1.113 5 g cm −3 ( 20 ° C ) 1.106 5 g cm −3 ( 30 ° C ) ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Selvantennelsestemperatur | 398 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Flammepunkt | 111 ° C (lukket kopp). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eksplosjonsgrenser i luft | 3,2–15,3% vol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
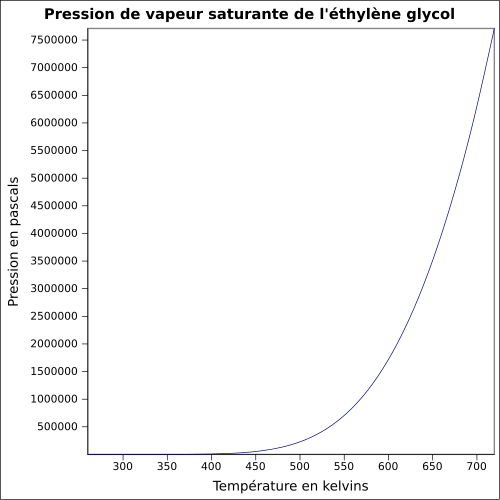
| Mettende damptrykk | ved 20 ° C : 7 Pa
ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dynamisk viskositet | (16,06 × 10 −3 Pa s ved 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritisk punkt | 8 MPa , 446,85 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lydens hastighet | 1658 m s −1 ved 25 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termokjemi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 gass, 1 bar | 303,8 J mol −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 væske, 1 bar | 163.2 J mol −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 gass | −392,2 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 væske | −460,0 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C s |
ligning:
ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCS | 1189,2 kJ mol −1 (væske) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroniske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re ioniseringsenergi | 10,16 eV (gass) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystallografi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystallklasse eller romgruppe | P 212121 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mesh-parametere |
a = 5,013 Å b = 6,915 Å |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volum | 321.38 Å 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Optiske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brytningsindeks | 1.4318 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forholdsregler | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Advarsel H302, H373, P260, P301, P312, P330, H302 : Farlig ved svelging H373 : Kan forårsake organskader (angi alle berørte organer, hvis kjent), etter gjentatt eksponering eller langvarig eksponering (angi eksponeringsvei hvis det er endelig bevist at ingen annen eksponeringsvei gir samme fare) P260 : Ikke pust støv / røyk / gass / tåke / damp / spray. P301 : Ved svelging: P312 : Ring et GIFTINFORMASJONSSENTER eller lege hvis du føler deg uvel. P330 : Skyll munnen. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 D2A, D2A : Meget giftig materiale som forårsaker andre toksiske effekter teratogenisitet og embryotoksisitet hos dyr. Opplysning om 0,1% i henhold til klassifiseringskriterier |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 2 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Innånding | Oppkast, lammelse | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Økotoksikologi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL 50 | 8,54 g kg -1 (rotte, oral) 6,61 (marsvin, oral) 13,79 ml kg -1 (mus, oral) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eksponeringsverdi | 10 ml m −3 , 26 mg m −3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| annen | Antenner ved kontakt med KMnO 4etter 10 til 20 s . | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | −1.93 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Luktterskel | lav: 0,08 spm høy: 25 spm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Enheter av SI og STP med mindre annet er oppgitt. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Den etylenglykol eller glykol eller etan-1,2-diol er den enkleste kjemisk forbindelse av familien av glykoler .
Dets strukturelle formel er HO - CH 2 -CH 2 -OHog dens urene formel C 2 H 6 O 2(det er den enkleste av diolene ). Etylenglykol er ofte brukt som et antifryse i bil kjølevæske . Ved romtemperatur er det en fargeløs, luktfri, tyktflytende væske med en søt smak. Etylenglykol er giftig og svelging krever øyeblikkelig legehjelp.
Etternavn
"Etan-1,2-diol" er den systematiske navn er definert av IUPAC nomenklatur innen organisk kjemi til et molekyl med to atomer av karbon (prefiks eth- ) med en binding Enkelt dem (suffiks -ane ) og festet til to grupper hydroksyl på hvert av de to karbonene (suffikset -1,2-diol ). "Etylenglykol" er det trivielle navnet som ofte brukes for etan-1,2-diol.
Historie
Etylenglykol ble først syntetisert i 1859 av den franske kjemi Charles Adolphe Wurtz via den forsåpning av etylenglykol-diacetat av kaliumhydroksid , på den ene side, og ved hydrering av hydrogen oksyd. Etylen på den annen side. Den ble produsert i små mengder under første verdenskrig som et kjølemiddel og som en komponent av eksplosiver . Dens industrielle produksjon begynte i 1937 , da forløperen, etylenoksid , selv ble produsert i industrielle mengder til lave kostnader.
Det forårsaket en liten revolusjon i luftfartsverdenen ved å erstatte vannet i kjølesystemet . Den høye koketemperaturen gjorde det mulig å redusere størrelsen på radiatoren og dermed vekten og dens aerodynamiske motstand. Før etylenglykol var tilgjengelig, brukte kjølesystemer høytrykksvann ; disse systemene var tungvint og upålitelige, og i luftkamp ble lett rammet av fiendens kuler.
Fysisk-kjemiske egenskaper
Etylenglykol er den enkleste av de vicinale dioler , og har spesielle fysikalsk-kjemiske egenskaper på grunn av sin struktur som omfatter to tilstøtende hydroksyl grupper langs den hydrokarbonkjeden.
Det er en fargeløs, luktfri, lav flyktighet og hygroskopisk væske med lav viskositet (16,06 × 10 −3 Pa s ved 25 ° C ). Det er fullstendig blandbart med mange polare løsningsmidler , som vann , alkoholer og aceton , og veldig lett løselig i ikke- polære løsningsmidler , som benzen , toluen , dikloretan eller kloroform .
Etylenglykol har en kryoskopisk molarkonstant på 3,11 K kg mol −1 og en ebullioskopisk molarkonstant på 2,26 K kg mol −1 .
-
Frysetemperatur.
-
Blandingens viskositet med vann.
-
Viskositet som en funksjon av temperatur.
Produksjon
Det syntetiseres fra etylen , via et etylenoksyd- mellomprodukt som reagerer med vann , i henhold til ligningen:
C 2 H 4 O + H 2 O → C 2 H 6 O 2
Denne reaksjonen kan katalyseres i et surt eller basisk medium , eller til og med ved høy temperatur. I et surt medium og med et overskudd av vann kan reaksjonsutbyttet nå 90%. De oligomerer av etylenglykol ( dietylenglykol , trietylenglykol , tetraetylenglykol ) kan oppnås på samme måte.
Reaktivitet og reaksjoner
Bruk av etylenglykol er begrenset av noen få forholdsregler:
- unngå kontakt med sterke oksidanter, aluminium , kromylklorid , alkalihydroksider, perklorsyre ;
- etylenglykol er brennbart, hygroskopisk , uforenlig med forskjellige syntetiske materialer. Det kan eksplodere ved kontakt med luft etter oppvarming i form av damp eller gass.
Etylenglykol brukes som en beskyttelsesgruppe for karbonylgrupper under syntetiske reaksjoner av organiske forbindelser. Behandling av et aldehyd eller keton med etylenglykol i nærvær av en syrekatalysator (f.eks. P-toluensulfonsyre; bortrifluorid) gir den tilsvarende 1,3-dioksolanen, som er motstandsdyktig mot virkningen av baser og andre nukleofile forbindelser. Videre kan 1,3-dioksolanbeskyttelsesgruppen deretter fjernes ved syrehydrolyse. I dette eksempelet er isoforonen beskyttet av etylenglykol og p-toluensulfonsyre i lavt utbytte. Vannet ble fjernet ved azeotrop destillasjon for å forskyve likevekten til høyre.
Den brukes for å beskytte karbonylfunksjonene i acetaliseringsreaksjonen .

bruk
Etylenglykol var mest kjent og brukes som frostvæske og kjølevæske . Det lave smeltepunktet har også blitt brukt som avis for vindruter og jetmotorer . Etylenglykol er først og fremst en kjemisk base innen petrokjemisk industri , der det muliggjør produksjon av tekstilfibre og polyesterharpikser , inkludert polyetylentereftalat , hovedmaterialet for plastflasker . Dens frostvæskeegenskaper gjør det også til en viktig komponent i løsninger beregnet på konservering av organisk vev ved lav temperatur.
Den høye koketemperaturen til etylenglykol og dens høye affinitet for vann gjør det til et ideelt tørkemiddel for produksjon av naturgass . I dehydreringstårnene blir den flytende etylenglykolen som strømmer fra toppen av tårnet, således laget for å møte blandingen av vann og gassformige hydrokarboner som rømmer fra bunnen. Glykolen tar opp vann og drenerer til bunnen, mens hydrokarbondampene samles opp på toppen. Etylenglykol injiseres deretter for å gjenta operasjonen.
Produktforgiftning
Den største faren med etylenglykol kommer fra toksisiteten ved svelging. På grunn av sin søte smak kan barn og kjæledyr innta store mengder etylenglykol hvis de er innen rekkevidde og tilfeller er langt fra sjeldne (over 7000 mistenkte forgiftninger i USA i 2011). Toksisiteten skyldes hovedsakelig metabolittene og ikke selve etylenglykol. Progresjonen av forgiftningssymptomer skjer i flere trinn. Den første er utseendet på nevrologiske symptomer. Offeret kan virke mildt beruset, klage over svimmelhet og se forvirret ut. Kroppen omdanner deretter etylenglykol til et annet toksin, oksalsyre, som vil utfelle i nyrene og forårsake akutt nyresvikt .
I tilfelle forgiftning kan det være en betydelig økning i blodlaktatnivåene , som faktisk er en falsk økning på grunn av den kjemiske nærheten mellom laktat og glykolnedbrytingsproduktene: glykolat og glykoksylat . Sistnevnte gir faktisk kryssreaksjoner med visse systemer for måling av laktatkonsentrasjonen. Det er også et "osmolar hull" med en målt osmolalitet mye høyere enn det som ble evaluert ved måling av natremi, glykemi og uremi .
Etylenglykol kan være dødelig for voksne. Uansett er det nødvendig med øyeblikkelig medisinsk hjelp. Hvis offeret fremdeles er ved bevissthet, gi ham mulig 100 ml (ett glass) sterk alkohol ved 45 ° å drikke. Den etanol erstatter faktisk etylenglykol med enzymer som nedbryter de sistnevnte mer giftige forbindelser, som begrenser produksjonen av toksiner (kjent som en konkurrerende inhibitor). Personen bør også føres til et sykehus der de kan gis, i stedet for etanol, andre hemmere av alkoholdehydrogenase, enzymet som er ansvarlig hos mennesker for å omdanne etanol til etanol. Etanol og etylenglykol i oksalsalt aldehyd , som vil transformere (takk til andre dehydrogenaser) til slutt til oksalat, som er giftig for det. En av disse hemmerne er fomepizol .
På grunn av sin toksisitet har etylenglykol allerede blitt snakket om i media:
- i 2007 ble glykol oppdaget i tannkremer fra Kina. Produsenter som ble enige om å svare på journalister forklarte at glykolen gjør at deigen får riktig konsistens. I prinsippet svelger du ikke tannkrem mens du pusser tennene, men i praksis kan det veldig bra skje, spesielt med barn.
sikkerhet
Brennbarhet
Ikke veldig brannfarlig i flytende tilstand, etylenglykol kan være eksplosiv i gassform. Det er derfor viktig å håndtere det i godt ventilerte rom (konsentrasjon mindre enn 100 mg m −3 ).
Den elektrolyse av etylenglykol med en sølvanode frembringer en eksotermisk reaksjon .
Forholdsregler
Etylenglykoldampene er irriterende før de er farlige. Kronisk eksponering er imidlertid kilden til patologier som er anerkjent i Frankrike som yrkessykdommer av personvernkoden .
Merknader og referanser
- ETHYLENE - GLYCOL , sikkerhetsark (er) til det internasjonale programmet for kjemisk sikkerhet , konsultert 9. mai 2009
- beregnede molekylmasse fra " atomvekter av elementene 2007 " på www.chem.qmul.ac.uk .
- D. R. Lide, 2007 , kap. 3 (“Fysiske konstanter av organiske forbindelser”), s. 232.
- (in) James E. Mark, Physical Properties of Polymer Handbook , Springer,2007, 2 nd ed. , 1076 s. ( ISBN 978-0-387-69002-5 og 0-387-69002-6 , leses online ) , s. 294
- (in) Yitzhak Marcus, The Properties of Solvents , vol. 4, England, John Wiley & Sons Ltd,1999, 239 s. ( ISBN 0-471-98369-1 )
- (no) Robert H. Perry og Donald W. Green , Perrys Chemical Engineers 'Handbook , USA, McGraw-Hill,1997, 7 th ed. , 2400 s. ( ISBN 0-07-049841-5 ) , s. 2-50
- D. R. Lide, 2007 , kap. 15 (“Praktiske laboratoriedata”), s. 17.
- DR Lide, 2007 , kap. 6 (“Fluid Properties”), s. 49.
- DR Lide, 2007 , kap. 14 (“Geofysikk, astronomi og akustikk”), s. 40.
- D. R. Lide, 2007 , kap. 5 ("Termokjemi, elektrokjemi og kinetikk"), s. 22.
- (i) Carl L. yaws, Handbook of Thermodynamic diagrammer: Organic Compounds C8 til C28 , vol. 1, Huston, Texas, Gulf Pub. Co.,1996, 396 s. ( ISBN 0-88415-857-8 )
- (in) David R. Lide , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press,18. juni 2002, 83 th ed. , 2664 s. ( ISBN 0849304830 , online presentasjon ) , s. 5-89
- DR Lide, 2007 , kap. 10 ("Atomisk, molekylær og optisk fysikk"), s. 213.
- " Etylenglykol " , på reciprocalnet.org (åpnet 14. juni 2012 )
- SDS etablert av Sigma-Aldrich [1]
- " Etylenglykol " i databasen over kjemikalier Reptox fra CSST (Quebec-organisasjonen med ansvar for arbeidsmiljø og helse), åpnet 24. april 2009
- " Etylenglykol " på hazmap.nlm.nih.gov (åpnet 14. november 2009 )
- "Ethane-1,2-diol" , på ESIS , åpnet 20. februar 2009
- CA Wurtz , “ Memoir on glycols or diatomic alcohols ”, Annal. Chim. Phys. , 3 E- serien, vol. 55,1859, s. 400-478 ( les online ).
- CA Wurtz , “ Syntese av glykol med etylenoksyd og vann ”, CR Hebd. Acad-økter. Sci. , vol. XLIX, n o 211859, s. 813-815 ( les online ).
- H. Yue, 2012 .
- DR Lide, 2007 , kap. 15 (“Praktiske laboratoriedata”), s. 28.
- DR Lide, 2007 , kap. 15 (“Praktiske laboratoriedata”), s. 27.
- http://xotxim.ru/etilenglikol/
- Bronstein AC, Spyker DA, Cantilena LR, Rumack BH og Dart RC, 2011 årsrapport fra American Association of Poison Control Centers 'National Poison Data System (NPDS): 29. årsrapport , Clin. Toxicol. (Phila), 2012, 50: 911-1164
- Guo C, Cenac TA, Li Y og McMartin KE, kalsiumoksalat, og ikke andre metabolitter, er ansvarlig for nyretoksisiteten til etylenglykol , Toxicol. Lett. , 2007, 173: 8-16
- Oostvogels R, Kemperman H, Hubeek I og ter Braak EW, Betydningen av osmolalitetsgapet i etylenglykolforgiftning , BMJ, 2013, 347: f6904
- INRS , "Fiche toxicologique n ° 25" , september 2016
- Brent J, McMartin K, Phillips S et al. , Fomepizole for behandling av etylenglykolforgiftning , N. Engl. J. Med. , 1999, 340: 832-838
Se også
Bibliografi
- (en) H. Yue , Y. Zhao et al. , “ Etylenglykol: egenskaper, syntese og anvendelser ” , Chem. Soc. Rev. , vol. 41,2012, s. 4218-4244 ( ISSN 0306-0012 , DOI 10.1039 / C2CS15359A ).
- (en) DR Lide ( dir. ), CRC Handbook of Chemistry and Physics , Boca Raton, FL, CRC Press ,2007, 88 th ed. , 2640 s. ( ISBN 978-0-8493-0488-0 ).
Relaterte artikler
Eksterne linker
- INRS, "Toksikologisk ark nr. 25" ,september 2016.
- Internasjonalt sikkerhetskort .