Toluen
| Toluen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struktur og representasjoner av toluen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikasjon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC-navn | toluen | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonymer |
metylbenzen |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100,003,297 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 203-625-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMIL |
Cc1ccccc1 , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / C7H8 / c1-7-5-3-2-4-6-7 / h2-6H, 1H3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Utseende | fargeløs væske med en karakteristisk lukt | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kjemiske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formel |
C 7 H 8 [Isomerer] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molarmasse | 92,1384 ± 0,0062 g / mol C 91,25%, H 8,75%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dipolar øyeblikk | 0,375 ± 0,010 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetisk følsomhet | 66,1 × 10 −6 cm 3 mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molekylær diameter | 0,568 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysiske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fusjon | −95 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° kokende | 110,58 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Løselighet |
0,53 g l −1 i uendelig vann i etanol , aceton , heksan , diklormetan |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Løselighetsparameter δ | 18,2 MPa 1/2 ( 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
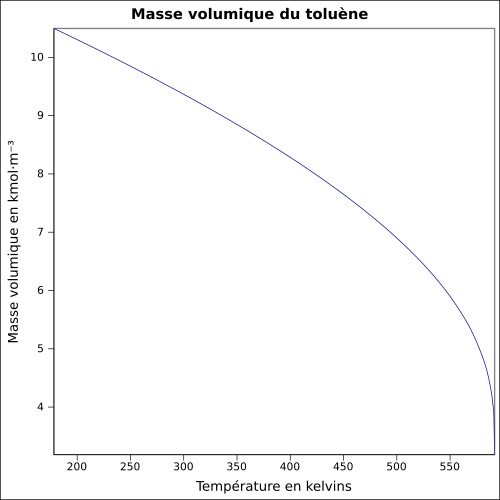
| Volumisk masse |
0,867 0 g cm −3
ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Selvantennelsestemperatur | 480 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Flammepunkt | 4 ° C (lukket kopp) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eksplosjonsgrenser i luft | 1,1–7,1 % vol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
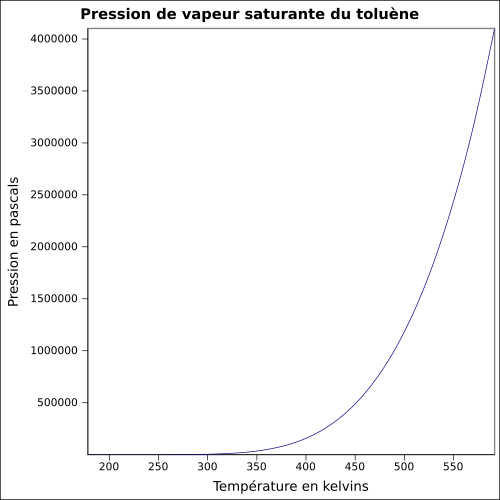
| Mettende damptrykk |
29 hPa ( 20 ° C )
ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dynamisk viskositet | 0,59 × 10 −3 Pa s ved 20 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| KINEMATISK viskositet | 0,681 × 10 −6 m 2 s −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritisk punkt | 318,65 ° C , 41,1 bar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termokjemi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C s |
ligning:
ligning:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCS | 3 910,3 kJ mol −1 ( 25 ° C , væske) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Optiske egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brytningsindeks | 1.4941 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forholdsregler | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Fare H225, H304, H315, H336, H361d, H373, H225 : Meget brannfarlig væske og damp H304 : Kan være dødelig ved svelging og kommer inn i luftveiene H315 : Gir hudirritasjon H336 : Kan forårsake døsighet eller svimmelhet H361d : Mistenkes å skade det ufødte barnet . H373 : Mistenkes for fare for alvorlig organskade (liste opp alle berørte organer, hvis kjent) etter gjentatt eksponering eller langvarig eksponering (angi eksponeringsvei hvis det er endelig bevist at ingen annen eksponeringsvei fører til samme fare) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B2, D2A, D2B, B2 brannfarlig væske flashpunkt = 4,4 ° C lukket skål Setaflash metode D2A : meget giftig materiale forårsaker andre toksiske effekter embryotoksisitet hos dyr D2B : giftig materiale med andre toksiske virkninger Hudirritasjon i dyr 'dyr Disclosure ved 0,1% i henhold til klassifiseringskriterier |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 2 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transportere | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1294 : TOLUENE |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IARC- klassifisering | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe 3: Kan ikke klassifiseres som kreftfremkallende for mennesker | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Innånding | Kvalme oppkast | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Økotoksikologi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 2.69 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ADI | 0,22 mg / kg kroppsvekt / dag | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Luktterskel | lav: 0,16 ppm høy: 37 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Enheter av SI og STP med mindre annet er oppgitt. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Den toluen , også kjent som metylbenzen eller fenylmetan er et aromatisk hydrokarbon . Det brukes ofte som et reagens eller løsningsmiddel , spesielt i det industrielle miljøet. Det løser opp et stort antall oljer , fett eller harpikser (naturlige eller syntetiske). Under normale forhold er det en gjennomsiktig væske med en karakteristisk lukt som minner om malingsfjerner eller beslektet benzen .
Historisk
Forbindelsen ble først isolert i 1837 ved destillasjon av furuolje av den polske kjemikeren Philippe Walter (in) som døpte den " retinnapht ". I 1841 isolerte den franske kjemikeren Henri St. Clair Deville av Tolu balsam (en) - et aromatisk ekstrakt fra det tropiske treet colombianske Myroxylon balsam - Deville identifiserer rétinnaphte Walter og benzen ; deretter kaller han dette nye hydrokarbonet " benzen ". I 1843 anbefalte Jöns Jacob Berzelius navnet " toluin ". I 1850 isolerte den franske kjemikeren Auguste Cahours et hydrokarbon fra et tredestillat som han anerkjente som identisk med " benzenen " i Deville som han døpte " toluen ".
Kjemiske egenskaper
Toluen reagerer som et normalt aromatisk hydrokarbon ved elektrofil aromatisk erstatning . Den metyl gruppe gjør det omtrent 25 ganger mer reaktivt enn benzen i slike reaksjoner. Ved sulfonering gir det paratoluensulfonsyre , mens klorering med klor i nærvær av jernklorid gir en blanding av orto- og para-isomerer av klortoluen. Nitrering med salpetersyre gir en blanding av orto- og paranitrotoluen. Ved oppvarming fortsetter reaksjonen å gi dinitrotoluen og til slutt trinitrotoluen (TNT) som er eksplosiv.
Den metyl -gruppen kan også reagere på andre oksidasjonsreaksjoner . Den kaliumpermanganat gir benzosyre , mens den kromylklorid gir benzaldehyd ( av Etard reaksjon ). En halogenering under radikale forhold gir benzylhalogenider. For eksempel oppnås benzylbromid med N-bromsuccinimid i nærvær av AIBN .
Den hydrogeneringskatalysator av toluen gir metylcykloheksan . På grunn av den spesielle stabiliteten til det aromatiske systemet krever denne reaksjonen et høyt trykk av hydrogen .
Fysiske egenskaper
Toluen er en væske under normale temperatur- og trykkforhold . Den er nesten uoppløselig i vann ( 0,535 g l -1 ved 25 ° C ), men blandbar med mange organiske løsningsmidler ( aceton , dietyleter , kloroform , etanol , etc. ), og løselig i iseddik .
Toluen har en kryoskopisk molalkonstant på 3,55 ° C kg mol −1 og en ebullioskopisk molalkonstant på 3,40 ° C kg mol −1 . Dampen er tyngre enn luft og danner en eksplosiv blanding med sistnevnte.
I proton-NMR vises toluen i form av flere topper mellom 7,28 ppm og 7 ppm for hydrogenene i benzenringen og som en singlett ved 2,38 ppm for hydrogenene i metylgruppen . I karbon-NMR vises toluen i flere topper, ved 137,8 ppm for α-karbonet av metyl, ved 129,09 ppm for β-karbonene, ved 128,28 ppm for y-karbonene og ved 125,38 ppm for karbon motsatt til metyl. Karbonet i metylgruppen viser en topp ved 25 ppm .
Den termiske ledningsevne (i W · m -1 · K -1 ) er 0,1425 til 0,00025 T , med T uttrykt i ° C .
Produksjon og syntese
Toluen er tilstede i lav andel i råolje . Det produseres vanligvis ved katalytisk reformering i bensinproduksjonen . Det oppnås også ved å sprekke i etylenfremstillingsprosessen , ellers fra kull . Den endelige rensingen gjøres ved destillasjon eller ved ekstraksjon .
Produksjon
I Frankrike, mellom de to krigene, ble produksjonen utført ved siden av pulveranlegget i Salin-de-Giraud (Bouches-du-Rhône). Dette etablissementet var ansvarlig for behandlingen av alle essenser som kommer fra Borneo (kamfer), kjøpt av pulveravdelingen , for å utvinne den toluen som er nødvendig for fremstilling av tolitt . Det var den eneste fabrikken av denne typen i Frankrike, og man kan forestille seg katastrofen som ville ha utgjort ødeleggelsen av den, eller bare dens avvikling. Under andre verdenskrig var produksjonen avgjørende for fremstilling av kraftige eksplosiver som TNT .
Den kjemiske industrien i Sovjetunionen produserte 245.500 tonn av dette produktet mellom 1940 og 1945, som ble tilsatt 103.000 tonn produsert av de allierte.
The Nazi-Tyskland hadde planlagt en produksjon på 9600 t i desember 1939 , og i september 1944 , hadde en produksjons 15 500 t , men har endelig produsert som 12 200 t .
Ifølge ECB produserte EU i 2003 nesten 16,75 millioner tonn toluen hvert år, hvorav 14 millioner var i form av blandinger innlemmet i bensin og 2,75 millioner i form av kommersiell toluen.
To av hovedprodusentene av dette produktet i 2006 er Total Petrochemicals og EniChem . I Frankrike , samme dato, ble det produsert 163 854 t toluen, 57 512 t importert og 11 237 t eksportert.
| forente stater | 10.900 |
| Japan | 6.100 |
| Sør-Korea | 3,080 |
| Kina | 2.830 |
| Den Europeiske Union | 2,040 |
| Canada | 1.630 |
bruk
Toluen brukes:
- for å øke oktantallet i drivstoff , blandet med benzen og xylener. Det er derfor til stede i forskjellige petroleumsbrensler;
- som et ekstraksjon oppløsningsmiddel i den kosmetiske industrien (parfyme) og i den farmakokjemiske industrien;
- som løsningsmiddel eller komponent ved fremstilling av maling , lakk, lakk , voks og blekk ( trykk osv.);
- utgangsmateriale for forskjellige industrielle prosesser : syntese av gummi , fenol , TNT , toluendiisocyanat (TDI), nødvendig for å oppnå skum av polyuretan , benzen og xylener, nitrotoluen, benzylklorid, benzaldehyd, p - syre toluensulfon, vinyltoluen, etc. ;
- i produksjon av lim og lim;
- i garvning av lær ;
- som en booster for overflatene til visse bordtennisspillere (til tross for forbudet).
Toksikologi, økotoksikologi, forholdsregler og metabolisme
Det er et skadelig og økotoksisk produkt (ofte tilstede i visse forurensede industrielle jordarter). Den akutte toksisiteten er lav, men dens primære målorganer er sentralnervesystemet (hjerne, marg). Det irriterer også huden, øynene og luftveiene.
Hos forsøksdyr induserer eksponering for betydelige nivåer av toluen generelle symptomer: hyperaktivitet, irritasjon av huden og spesielt slimhinnene (rennende nese, tårer), irritasjon i luftveiene, med kortpustethet. Ved eksponeringsnivåer over 2000 ppm i luft er neste trinn narkose ( ataksi , forverring av kognitive funksjoner, balanseforstyrrelser og nevrokjemiske endringer. Døden skyldes respirasjonsstans. Indusert av utarmning av sentralnervesystemet).
Irritasjonen øker i henhold til varigheten av eksponeringen og dosen: hos kaninen vises et moderat erytem og deretter et svakt ødem etter 72 timer, irreversibelt etter 7 dager, og - fortsatt hos kaninen - skylling av det eksponerte øyet etterpå. 4 og 30 sekunder reduserer ikke intensiteten på irritasjonen.
Dens kroniske toksisitet er studert hos forsøksdyr (mus, rotte) der vi observerer:
- en økning i vekten av forskjellige organer som er involvert i avgiftning (lever, nyre, for eksempel etter eksponering for 1250 ppm i 15 dager hos rotter; ved 2500 ppm vokser rotten fett, med en økning i vekten av hjernen, hjertet, lunger og testikler , med symptomer på dyspné og ataksi);
- en endring i nivået av nevrotransmittere ;
- en nevrotoksisitet som særlig påvirker hippocampus og lillehjernen ;
- ototoksisitet hos rotter med en synergistisk interaksjon med støy;
- lang eksponering (2 år ved 1500 ppm ) hos rotter indusert betennelse i neseslimhinnene med erosjon av olfaktorisk epitel , metaplasi og degenerasjon av luftveiene, men under 300 ppm har ingen symptomer blitt observert ( NOAEL eller konsentrasjon uten observert giftig effekten var 625 ppm for en eksponering på 6,5 timer per dag, 5 dager per uke i 15 uker, eller 300 ppm over en eksponeringsperiode på 2 år. oral, NOAEL for rotter og mus var 625 mg kg -1 d -1 for 13 uker).
Toluen ser ikke ut til å ha effekter på DNA in vivo , mens det gjør det in vitro .
Via huden eller ved innånding ser det ikke ut til å være kreftfremkallende , men som et løsningsmiddel kan det bidra til at kreftfremkallende produkter kommer inn i kroppen.
Toluen er reproduksjonstoksisk (nedsatt fruktbarhet i hastigheter der det ikke er giftig for mor, hos rotter). Det svekker også fertiliteten hos menn via en endring i spermatogenesen og / eller kanskje funksjonen av epididymis: 20% reduksjon i antall spermatozoer uten reduksjon i deres mobilitet under 6000 ppm . Utover det reduseres antall spermatozoer, så vel som deres mobilitet, men uten endring av testikkelvekt eller testikulær spermatogenese, og uten endring i hormonnivåer etter en måneds eksponering [17]. Fertilitet påvirkes ikke under 600 ppm .
Det passerer lett inn i embryoet, og induserer over 600 ppm hos dyr (ingen data for mennesker) forsinkelse av vekst og vekt ved fødselen og postnatale psykomotoriske lidelser som reflekterer toluenens nevrotoksisitet for den embryonale hjernen, men uten ytre misdannelser, inkludert ved inhalasjon. Det er ikke kjent å være teratogent in vivo eller in vitro . EU har klassifisert det som reproduksjonstoksisk, kategori 3 , R 63 .
Kinetikk i kroppen
Selv i flytende form krysser den hudbarrieren dårlig (14 til 23 mg / cm 2 per time) og i dampform enda mindre (4,6 μg / cm 2 per time for nakenmus eksponert for 1000 ppm , mens rottehud, in vitro , absorberer 0,78 μg / cm 2 per minutt.).
Imidlertid krysser den lett lungeslimhinnen i begge retninger (10-20% av toluen som inntas og / eller inhaleres, skilles deretter ut i form av damp via utløpet). Nivået av utåndet benzen øker etter inntak av etylalkohol , sistnevnte hemmer metabolismen av toluen, noe som reduserer utskillelsen i urinen.
Innånding av toluen damp er skadelig. I høye doser induserer det kvalme . Langvarig kronisk innånding av toluen forårsaker irreversibel hjerneskade . Fra lungene transporteres den av blodet, halvparten festet til hemoglobin og halvparten i serum (hos mennesker; hos rotter transporteres det hovedsakelig med serum). Det kan påvises i blodet 10 til 15 minutter etter eksponeringsstart (med en hastighet som er høyere jo høyere nivået av benzen var i luften som pustes; graden av absorpsjon (ca. 50% av konsentrasjonen) avhenger også av hastighet på lungeventilasjon . Vi kan derfor anta at joggere som løper nær en stor sirkulasjonsakse er mer utsatt for den. Den passerer raskt gjennom hjernen: eksperimentelt eksponerte rotter viser en topp i blodet 53 minutter etter eksponering og 5 minutter senere (58 min ) i hjernen (rik på fettvev). det er også funnet i marg ben og rygg , den fettvev , den lever og nyrer .
Toluen absorberes også veldig godt via mage-tarmkanalen; med (hos mennesker og rotter) en påvisbar topp i blodet omtrent to timer etter inntak.
Det blir knapt filtrert av morkaksbarrieren; hos rotter er konsentrasjonen i fosteret omtrent 75% av den i mors blod. Brystmelk, hvis den inneholder noen, tillater også overføring fra mor til barn (hos mennesker og dyr).
Den toksisitet av toluen er forklart av sin metabolisme . Ettersom toluen er veldig lite løselig i vann, kan den ikke forlate kroppen på tradisjonell måte (urin, avføring, svette). Det må metaboliseres for å skilles ut . Den methyl gruppe toluen oksyderes lettere enn den aromatiske ring. Denne reaksjonen utføres i leveren av cytokrom P450 monooxygenases . Som et resultat blir 95% av toluen omdannet til benzylalkohol . Det er de resterende 5% som skaper de giftige metabolittene, epoksyene i den aromatiske kjernen. Det store flertallet av disse epoksidene er konjugert med glutation , men det lille som klarer å unnslippe, skader cellemaskineriet alvorlig ved å alkylere visse proteiner , til og med DNA .
Toluen utskilles hovedsakelig via urinen som benzoesyre - oppnådd ved enzymatisk oksidasjon av benzylalkohol - og som hippursyre oppnådd ved konjugering av benzoesyre med glycin .
Synergier
Mange synergier er sannsynlig, da toluen er et sterkt løsemiddel. Det er for eksempel kjent at toluen- xylen- kombinasjonen ved metabolsk konkurranse induserer en økning i nivået (blod og cerebral) av toluen.
Bindende grenseverdier for yrkeseksponering
I Frankrike er de 20 ppm eller 77 mg m -3 (8 timer) og 100 ppm 384 mg m -3 (for kortvarig eksponering, eller 15 min ) fremstilles ved resolusjon n o 2012-746 av9. mai 2012. Disse verdiene brukes spesielt for å lage regulatorisk dosimetri bestemt av dekret nr . 2009-1570 av15. desember 2009.
Merknader og referanser
- TOLUENE , sikkerhetsark (er) til det internasjonale programmet for sikkerhet for kjemiske stoffer , konsultert 9. mai 2009
- (i) David R. Lide, håndbok for kjemi og fysikk , Boca Raton, CRC,16. juni 2008, 89 th ed. , 2736 s. ( ISBN 978-1-4200-6679-1 ) , s. 9-50
- (i) Hyp J. Daubensee Jr. , James D. Wilson og John L. Laity, " diamagnetisk Mottakelighet opphøyet i Hydrocarbons " , Journal of American Chemical Society , vol. 91, n o 8,9. april 1968, s. 1991-1998
- (in) Yitzhak Marcus, The Properties of Solvents , vol. 4, England, John Wiley & Sons ,1999, 239 s. ( ISBN 0-471-98369-1 ) , s. 85
- beregnede molekylmasse fra " atomvekter av elementene 2007 " på www.chem.qmul.ac.uk .
- (i) Iwona Owczarek og Krystyna Blazej, " Anbefalte kritiske temperaturer. Del II. Aromatiske og sykliske hydrokarboner ” , J. Phys. Chem. Ref. Data , vol. 33, n o to30. april 2004, s. 541 ( DOI 10.1063 / 1.1647147 )
- (in) James E. Mark, Physical Properties of Polymer Handbook , Springer,2007, 2 nd ed. , 1076 s. ( ISBN 978-0-387-69002-5 og 0-387-69002-6 , leses online ) , s. 294
- (in) JG Speight and Norbert Adolph Lange , Lange's Handbook of Chemistry , McGraw-Hill,2005, 16 th ed. , 1623 s. ( ISBN 0-07-143220-5 ) , s. 2.289
- (en) Robert H. Perry og Donald W. Green , Perrys Chemical Engineers 'Handbook , USA, McGraw-Hill,1997, 7 th ed. , 2400 s. ( ISBN 0-07-049841-5 ) , s. 2-50
- Tekniske ingeniørutgaver, artikkel B 1201
- " Properties of Various Gases ", på flexwareinc.com (åpnet 12. april 2010 )
- (i) Carl L. yaws, Handbook of Thermodynamic diagrammer: Organic Compounds C8 til C28 , vol. 2, Huston, Texas, Gulf Pub.,1996, 396 s. ( ISBN 0-88415-858-6 )
- (in) David R. Lide , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press,18. juni 2002, 83 th ed. , 2664 s. ( ISBN 0849304830 , online presentasjon ) , s. 5-89
- " ESIS " (tilgjengelig 06.12.2008 )
- IARC arbeidsgruppe om evaluering av kreftfremkallende risikoer for mennesker, " Evaluations Globales de la Carcinogenicité pour l'Homme, Groupe 3: Unclassables as to their carcinogenicity to Humans " , på monographs.iarc.fr , IARC,16. januar 2009(åpnet 22. august 2009 )
- Indeksnummer i tabell 3.1 i vedlegg VI til EF-forskrift nr. 1272/2008 (16. desember 2008)
- " Toluen " i databasen over kjemikalier Reptox fra CSST (Quebec-organisasjonen som er ansvarlig for arbeidsmiljø og helse), åpnet 25. april 2009
- Akseptable daglige konsentrasjoner / inntak og tumorigene konsentrasjoner / doser av prioriterte stoffer beregnet i henhold til helsekriterier , publisert av Health Canada
- " Toluen " på hazmap.nlm.nih.gov (åpnet 14. november 2009 )
- Pelletier og Walter (1837) "Gjennomgang av produkter fra harpiksforedling ved produksjon av gass til belysning" , Proceedings , 4 : 898–899.
- Pelletier og Philippe Walter (1838) "Undersøkelse av produktene som følge av behandling av harpiks ved fremstilling av gass til belysning," Annales de Chimie et de Physique , 2. serie, 67 : 269-303. Toluene heter pp. 278-279: “Vi vil betegne stoffet som berører oss med navnet retinnaphtus , som husker dets opprinnelse og dets fysiske egenskaper (ρητίνη-νάφτα). "
- Deville (1841) " Undersøkelser av harpiks. Studie av Tolu balsam", Proceedings , 13 : 476–478.
- H. Deville (1841) " Kjemiske undersøkelser av harpiks; Første erindringsbok" (Kjemiske undersøkelser av harpiks; første erindringsbok), Annales de Chimie et de Physique , 3. serie, 3 : 151-195. Deville kaller toluen på s. 170: “For kroppen som bekymrer meg for øyeblikket, har jeg adoptert navnet benzen , som i balsamene som det kommer fra, minnes denne nesten generiske karakteren som skal inneholde benzoesyre. "
- Jaime Wisniak , “ Henri Étienne Sainte-Claire Deville: En lege ble metallurg ”, Journal of Materials Engineering and Performance , vol. 13, n o to2004, s. 117–118 ( DOI 10.1361 / 10599490418271 , Bibcode 2004JMEP ... 13..117W )
- Jacob Berzelius (1843) Jahres Berichte , 22 : 353-354. .
- Cahours, Auguste (1850) "Forskning på lette oljer oppnådd i destillasjon av tre" (Undersøkelser av lette oljer oppnådd ved destillasjon av tre), Rapporter , 30 : side 320
- Jaime Wisniak (oktober 2013) "Auguste André Thomas Cahours," Educación Química , 24 (4): 451–460.
- Sovjetunionens økonomi i 1941-1945
- (in) Vedlegg D. Strategisk luftangrep på pulver- og eksplosivindustrien: Tabell D6 Anlegg for produksjon av råvarer til pulver og eksplosiver
- INERIS - Tekniske og økonomiske data om kjemiske stoffer i Frankrike: Toluen [PDF]
- Aromatiske hydrokarboner , French Society of Chemistry
- Campo P. et al. , Toluen-indusert hørselstap: En midtfrekvensplassering av cochlea-lesjonene , Neurotoksikologi og Teratologi , 1997, 19: 129-40.
- Søren Lund og Gitte Kristiansen , “ Hazards to Hearing from Combined Exposure to Toluene and Noise in Rats ”, International Journal of Occupational Medicine and Environmental Health , vol. 21, n o 1,1 st januar 2008( ISSN 1896-494X og 1232-1087 , DOI 10.2478 / v10001-008-0008-x , leses online , åpnet 26. februar 2019 )
- R. Lataye og P. Campo , “ kombinerte effekten av en simultan utsatt for støy og toluen på hørselsfunksjonen ”, Neurotoxicology og teratologi , vol. 19, n o 5,September 1997, s. 373–382 ( ISSN 0892-0362 , PMID 9380004 , lest online , åpnet 26. februar 2019 )
- Guillot J.-P. et al. , Evaluering av kutan-irritasjonspotensialet til 56 forbindelser , Food and Chemical Toxicology , 1982, 20: 563-572.
- Guillot J.-P. et al. , Evaluering av okulærirritasjonspotensialet til 56 forbindelser , Food and Chemical Toxicology , 1982, 20: 573-582.
- Toxicity sammendrag for toluen. Toksisitetsprofiler, Informasjonssystem om risikovurdering , 1994. Tilgjengelig på http://risk.lsd.ornl.gov/tox/rap_toxp.shtml
- Toksikologi og karsinogenesestudier av toluen (CAS nr. 108-88-3) i F344 / N rotter og B6C3F1 mus (inhalasjonsstudier) , toksisitetsanalyse TR- 371, NTP, 1990. Link NIEHS
- Toluen . I: IARC monografier om evaluering av kreftfremkallende risiko for mennesker , Lyon: IARC, 1999, 71 (2); 829-864.
- Toksikologi- og karsinogenesestudier av toluen (CAS-nr. 108-88-3) i F344 / N-rotter og B6C3F1-mus (inhalasjonsstudier) , toksisitetsgjennomgang TR-371, NTP; 1990. NIEHS nettsted
- Toluen , toluenark fra DEMETER. Dokumenter for medisinsk vurdering av reproduksjonstoksiske produkter , INRS, 2006
- Dalgaard M. et al. , Utviklingstoksisitet av toluen hos hannrotter: effekter på sædkvalitet, testis morfologi og apoptotisk nevrodegenerasjon , Archives of Toxicology , 2001, 75 (2): 103-109.
- Wilkins-Haug L., Teratogen-oppdatering: toluen , Teratology , 1997, 55: 145-151.
- Ono A. et al. , Toluen inhalasjon indusert epididymal spermdysfunksjon hos rotter , Toxicology , 1999, 139 (3): 193-205.
- INRS toksikologisk ark, tilgjengelig via de eksterne lenkene på denne siden
Se også
Relaterte artikler
- Xylen , benzen med to metylgrupper
- Nitrotoluen , toluen substituert med en nitrogruppe
- Dinitrotoluen , toluen substituert med to nitrogrupper
- Trinitrotoluentoluen substituert med tre nitrogrupper
- Toluidine , toluen substituert med en amingruppe
Eksterne linker
- Toksikologisk ark , INRS.
- Biotox-database , INRS.
- Internasjonalt sikkerhetsdatablad , på www.cdc.gov .